题目内容
10.纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空: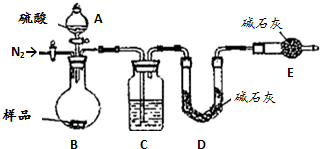
方案一:纯碱样品$\stackrel{加热}{→}$测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热.坩埚中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是:加热至恒重,以保证NaHCO3全部分解.
方案二:称取mg样品配成250mL溶液,从中取25mL溶液先用酚酞作指示剂用0.1mol•L-1HCl溶液滴定至终点,消耗0.1mol•L-1HCl溶液V1mL,继续用甲基橙作指示剂滴定至终点,消耗0.1mol•L-1HCl溶液V2mL.则该样品中碳酸钠的质量分数为:$\frac{106{V}_{1}}{106{V}_{1}+84({V}_{2}-{V}_{1})}$×100%.
方案三:纯碱样品溶液$\stackrel{氯化钙溶液}{→}$测定沉淀质量
(3)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液.将反应混和物过滤后的下一步操作是:洗涤沉淀,沉淀经干燥后称量为m2g.
(4)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际不变(填“偏高”、“偏低”或“不变”).
方案四:纯碱样品$\stackrel{加热}{→}$测定生成二氧化碳的质量
(5)本实验采用如下图装置,C中盛放的物质是浓硫酸.
(6)反应前后都要通入N2,反应后通入N2的目的是排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收.
分析 方案一:(1)该方案原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,从而根据残留的固体的量推算出样品中碳酸钠的质量分数.
(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解.
方案二:根据实验原理,用酚酞作指示剂时,发生反应为:Na2CO3+HCl=NaHCO3+NaCl,用0.1mol•L-1 HCl溶液滴定至终点,消耗0.1mol•L-1 HCl溶液V1 mL,继续用甲基橙作指示剂滴定至终点,发生反应::NaHCO3+HCl=H2O+CO2↑+NaCl,由此分析计算;
方案三:该方案原理为在样品中加入CaCl2溶液,其中Na2CO3可与CaCl2发生反应Na2CO3+CaCl2=CaCO3↓+2NaCl,而NaHCO3与CaCl2则不反应.从而根据产生的沉淀量,得出纯碱的质量分数,方案关键是测定CaCO3沉淀的质量,自然要保证沉淀完全,要正确过滤好.
(3)沉淀会附着氯化钠、氯化钙.
(4)在一定量样品中加入足量Ca(OH)2溶液,此时分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总量和生成CaCO3沉淀的量,就可得出纯碱的质量分数.
方案四:该方案原理为一定量混合样品与足量的稀硫酸分别发生如下反应Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,
2 NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O↑,根据所产生的CO2的质量,可以分别求得样品中Na2CO3和NaHCO3的质量从而得出纯碱的质量分数.该方案关键是要获得产生的CO2的质量,在实验前要检查装置的气密性,要将装置中的CO2全部被碱石灰所吸收,要称量碱石灰在吸收CO2前后的质量.
(5)C装置干燥二氧化碳.
(6)实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差.
解答 解:方案一:(1)坩埚中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;保证NaHCO3全部分解.
(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解,故答案为:加热至恒重,以保证NaHCO3全部分解;
方案二:根据实验原理,用酚酞作指示剂时,发生反应为:Na2CO3+HCl=NaHCO3+NaCl,用0.1mol•L-1 HCl溶液滴定至终点,消耗0.1mol•L-1 HCl溶液V1 mL,应根据V1来计算碳酸钠的质量;继续用甲基橙作指示剂滴定至终点,发生反应::NaHCO3+HCl=H2O+CO2↑+NaCl,消耗0.1mol•L-1HCl溶液V2mL.根据(V2-V1)计算NaHCO3的质量,则Na2CO3的质量分数为:$\frac{0.1mol/L×{V}_{1}×106g/mol}{0.1mol/L×{V}_{1}×106g/mol+0.1mol/L×({V}_{2}-{V}_{1})×84g/mol}$=$\frac{106{V}_{1}}{106{V}_{1}+84({V}_{2}-{V}_{1})}$×100%,故答案为:$\frac{106{V}_{1}}{106{V}_{1}+84({V}_{2}-{V}_{1})}$×100%;
方案三:
(3)碳酸钙沉淀会附着氯化钠、氯化钙,过滤后需用蒸馏水洗涤沉淀;故答案为:洗涤沉淀;
(4)在一定量样品中加入足量Ca(OH)2溶液,此时分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总量和生成CaCO3沉淀的量,可以计算碳酸钠质量,就可得出纯碱的质量分数.故用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数不变;故答案为:不变;
方案四:
(5)C装置干燥二氧化碳,所以C中盛放的物质是浓硫酸,故答案为:浓硫酸;
(6)该方案关键是要获得产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N2,反应后通入N2的目的是:排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收,
故答案为:排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收.
点评 以实验探究“工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数”为载体,考查学生对于实验原理与装置理解评价、实验基本操作、化学计算等,难度中等,题目涉及到的小苏打和纯碱的化学知识是多方面的,构成了一道多角度的探究题.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 用Fe2+将饮用水中少量ClO2-氧化成为Cl-:4Fe2++ClO2-+4H+═4Fe3++Cl-+2H2O | |
| B. | 向烧碱溶液中加入铝:Al+2OH-═AlO2-+H2↑ | |
| C. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O═SO32-+2NH4++H2O | |
| D. | 将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
| A. | 溴乙烷和水 | B. | 苯酚和乙醇 | C. | 酒精和水 | D. | 乙醛和苯 |




 ,若该烷烃可由3种单烯烃与H2加成得到,则该烯烃可能的结构简式是CH2=C(CH3)CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2.
,若该烷烃可由3种单烯烃与H2加成得到,则该烯烃可能的结构简式是CH2=C(CH3)CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2.