题目内容
5.现有6种物质:①MgCl2 ②HCl ③SO2 ④K2CO3 ⑤CaO ⑥NaOH请根据下列标准,对上述物质进行分类(填序号):
(1)属于共价化合物是②③.
(2)只含离子键的化合物是①⑤.
(3)含共价键的离子化合物是④⑥.
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,含有离子键的化合物属于离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,共价化合物中一定不含离子键.
解答 解:①MgCl2中镁离子和氯离子之间只存在离子键,属于离子化合物;
②HCl分子中H-Cl原子之间只存在共价键,属于共价化合物;
③SO2分子中C与O原子之间只存在共价键,属于共价化合物;
④K2CO3中钾离子和碳酸根离子之间存在离子键、O与C原子之间存在共价键,属于离子化合物;
⑤CaO中钙离子和氧离子之间只存在离子键,属于离子化合物;
⑥NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,属于离子化合物;
(1)通过以上分析知,属于共价化合物的是②③,故答案为:②③;
(2)只含有离子键的是①⑤,故答案为:①⑤;
(3)含共价键的离子化合物是④⑥,故答案为:④⑥.
点评 本题考查化学键和化合物的关系,侧重考查基本概念,明确物质构成微粒及存在的化学键即可解答,注意离子键和共价键的区别.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
16.下列说法中正确的有的是( )
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 可以找到一种催化剂使水变成汽油 | |
| D. | 催化剂是决定化学反应速率的主要因素 |
20.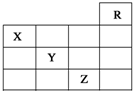 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐
②同浓度的Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质常温下是深红棕色液体,具有氧化性
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐
②同浓度的Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质常温下是深红棕色液体,具有氧化性
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A. | 只有③ | B. | 只有①④ | C. | 只有①②③④ | D. | ①②③④⑤ |
15.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为同位素;R在元素周期表中的位置是第三周期ⅦA族.
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑.
(3)Y与R相比,非金属性较强的是Cl(填元素符号),下列事实能证明这一结论的是bc.(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4 c.Y与R形成的化合物中Y呈正价.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑.
(3)Y与R相比,非金属性较强的是Cl(填元素符号),下列事实能证明这一结论的是bc.(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态 b.稳定性XR>YX4 c.Y与R形成的化合物中Y呈正价.

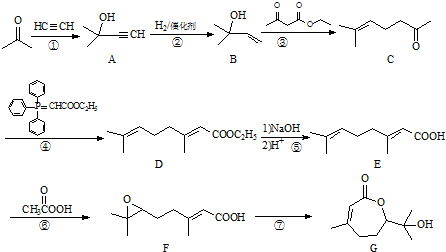
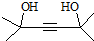 .
.
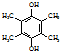
 ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.