题目内容
下列溶液一定呈中性的是( )
| A.c(H+)=c(OH-)=10-6mol/L溶液 | B.pH=7的溶液 |
| C.使石蕊试液呈紫色的溶液 | D.酸与碱恰好完全反应生成正盐的溶液 |
A
解析试题分析:A、判断溶液酸碱性的依据是c(H+)、c(OH-)的相对大小,当溶液中c(H+)=c(OH-)时,溶液呈中性,正确;B、室温时,pH=7的溶液呈中性,温度改变,KW改变,pH=7的溶液不一定呈中性,错误;C、石蕊在pH为5到8时都是紫色,可能为酸性、中性或碱性,错误;D、酸与碱反应生成的正盐若是强酸强碱盐,则为中性,若为强碱弱酸盐,则为碱性,若为强酸弱碱盐,则为酸性,错误。
考点:考查溶液的酸碱性的判断。

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
把0.05molNaOH固体分别加入下列100mL溶液中,溶液的导电能力变化不大的是( )
| A.自来水 | B.0.5mol·L—1KOH溶液 |
| C.0.5mol·L—1醋酸 | D.0.5mol·L—1NH4Cl溶液 |
已知:CaC2O4沉淀的Ksp=2.3×10-9,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓度为1×10-2mo1·L-1,则生成沉淀所需Na2C2O4溶液的最小起始浓度为
| A.2. 3×10-7mol·L-1 | B.4. 6×10-7mol·L-1 |
| C.9. 2×10-7mol·L-1 | D. ×10-3mol·L-1 ×10-3mol·L-1 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
 mol/L
mol/LB.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂。
已知Pb2+与这些离子形成的化合物的溶解度如下表:
| 化合物 | PbSO4 | PbCO3 | PbS |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
A.硫酸盐 B.碳酸盐
C.硫化物 D.任何一种即可
25 ℃在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH = 10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×109 |
| C.1∶20∶1010∶109 | D.1∶10 ∶104∶109 |
下列说法正确的是
| A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子 |
| B.强电解质的水溶液导电性强于弱电解质的水溶液 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.强电解质易溶于水,弱电解质难溶于水 |
下列溶液中离子浓度大小关系错误的是
A.0.1 mol/L的NH4Cl溶液中: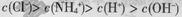 |
B.0.1mol/L的CH3COONa溶液中: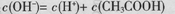 |
C.0.1 mol/LNa2S的溶液中: |
D.pH=2的盐酸与pH=12的氨水等体积混合后: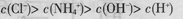 |
常温下,浓度均为0.1mol/L的溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(NH4+)+c(NH3·H2O)=0.05mol/L |
| D.①和③等体积混合后的溶液pH>7:c(NH4+)>c(Cl—)>c(OH-)>c(H+) |