题目内容
2.短周期中的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5,X元素原子的最外层电子数是Y和Z两元素原子的最外层电子数的总和;Y元素原子的最外层电子数是它的电子层数的2倍,且Y元素最高正价与最低负价的绝对值相等,X和Z可以形成XZ3的化合物.请回答:(1)X、Y、Z三种元素的元素符号分别为:XN,YC,ZH.
(2)X元素在周期表中的位置是第二周期ⅤA族.
(3)写出X的氢化物与它的最高价氧化物对应水化物反应的化学方程式:NH3+HNO3=NH4NO3.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一.它被氢氧化钠溶液吸收的化学方程式是:
2XO2+2NaOH═M+NaXO3+H2O(已配平),产物M化学式为NaNO2.
分析 短周期中的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5,则Z处于第一周期,X、Y处于第二周期,可推知Z为H元素;Y元素原子的最外层电子数是它的电子层数的2倍,则其最外层电子数为4,则Y为C元素,其最高正价等于最低负价;X元素原子的最外层电子数是Y和Z两元素原子的最外层电子数的总和,X最外层电子数为4+1=5,则X为氮元素,能与H元素形成NH3,据此解答.
解答 解:短周期中的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5,则Z处于第一周期,X、Y处于第二周期,可推知Z为H元素;Y元素原子的最外层电子数是它的电子层数的2倍,则其最外层电子数为4,则Y为C元素,其最高正价等于最低负价;X元素原子的最外层电子数是Y和Z两元素原子的最外层电子数的总和,X最外层电子数为4+1=5,则X为氮元素,能与H元素形成NH3,
(1)由上述分析可知,X、Y、Z三种元素的元素符号分别为N、C、H,
故答案为:N;C;H;
(2)氮元素处于元素周期表中第二周期ⅤA族,
故答案为:二;ⅤA;
(3)X为氮元素,X的氢化物为氨气,与它的最高价氧化物对应水化物为硝酸反应的化学方程式为NH3+HNO3=NH4NO3,
故答案:NH3+HNO3=NH4NO3;
(4)根据化学方程式2XO2+2NaOH═M+NaXO3+H2O(已配平),利用元素守恒可知产物M化学式为NaNO2,
故答案为:NaNO2;
点评 本题考查结构性质位置关系,推断元素是解题的关键,注意根据最外层电子数之和确定Z是推断的突破口,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.将Mg、Cu组成的混合物13.2g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体4.48L(无其他还原产物),向反应后的溶液中加入过量的2.5mol•L-1的NaOH溶液300mL,金属离子完全沉淀.则形成沉淀的质量是( )
| A. | 21.6g | B. | 26.8g | C. | 23.4g | D. | 31.9g |
13.对下列有机反应类型的认识中,错误的是( )
| A. | 苯乙烯使溴水褪色;加成反应 | |
| B. | 乙烯水化生成乙醇;取代反应 | |
| C. | 乙醇与CuO加热反应生成乙醛;氧化反应 | |
| D. | 无水乙醇与浓硫酸加热到170℃制取乙烯;消去反应 |
10.将0.4mol金属Al全部转化为Al(OH)3,消耗a mol HCl、b mol NaOH,则a+b的最小值为( )
| A. | 1.6 | B. | 0.8 | C. | 0.6 | D. | 0.4 |
17.在H2SO3溶液中,在采取措施使c(H+)减小的同时,c(SO${\;}_{3}^{2-}$)的变化情况是( )
| A. | 增大 | B. | 减小 | ||
| C. | 不变 | D. | 可能增大也可能减小 |
14.可用于判断碳酸氢钠固体粉末中混有碳酸钠的实验方法是( )
| A. | 加热时无气体放出 | |
| B. | 溶于水后滴加稀BaCl2溶液有白色沉淀生成 | |
| C. | 滴加盐酸时有气泡放出 | |
| D. | 溶于水后滴加澄清石灰水有白色沉淀生成 |
11.下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A. | 实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸 | |
| B. | 用MgCl2•6H2O制取无水MgCl2时需在HCl气流中进行 | |
| C. | 饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 | |
| D. | 合成氨工业中使用铁触媒做催化剂 |
12.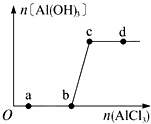 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Fe3+、SO4-、HCO3- | |
| B. | b点对应的溶液中:Na+、S2-、SO42-、Cl- | |
| C. | c点对应的溶液中:Ag+、Ca2+、NO3-、F- | |
| D. | d点对应的溶液中:K+、NH4+、CO32-、I- |