题目内容
12.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.硫、氮、稀土元素的单质和化合物应用广泛.(1)将硫铁矿和焦炭按物质的量比3:2混合放在炼硫炉中,通入适量空气,恰好完全反应发生下列燃烧反应:
FeS2+C+O2--→Fe3O4+CO+S;
①请配平上述化学反应方程式3FeS2+2 C+3O2=Fe3O4+2CO+6S,生成3mol硫时,转移的电子的物质的量为6mol.
②请写出FeS2的电子式
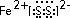 .
.(2)过硫酸钾,化学式为:K2S2O8,过硫酸结构式为:

①过硫酸钾和过硫酸均有强氧化性,不稳定,容易分解,如2H2S2O8=2H2SO4+2SO3+O2
下列能加快过硫酸分解的固体物质是A B C
A.CuO B.MnO2 C.Fe2O3 D.Na2SO4
②已知硫酸锰(MnSO4)和过硫酸钾两种盐溶液在催化剂存在下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸.请写出上述反应的化学方程式8H2O+2MnSO4+5K2S2O8=2KMnO4+4K2SO4+8H2SO4
③若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的氧化产物还有氯气
(3)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,由CeCl3•6H2O制备无水CeCl3应采取的措施是在通入氯化氢气体的条件下加热除去结晶水.
分析 (1)①反应3FeS2+12C+8O2=Fe3O4+12CO+6S中,Fe元素化合价部分由+2价升高到+3价,S元素化合价由-1价升高到0价,C元素化合价由0价升高到+2价,依据电子守恒和原子守恒配平书写化学方程式和计算电子转移;
②FeS2为离子化合物,亚铁离子和过硫根离子构成;
(2)①类比CuO、MnO2、Fe2O3对过氧化氢分解的催化作用可做出判断;
②反应后生成H2SO4说明有水参加反应,根据化合价变化情况配平后即得化学方程式;
③已知高锰酸钾可氧化盐酸,如生成高锰酸钾,则一定生成氯气;
(3)在加热条件下CeCl3易发生水解,由CeCl3•6H2O制备无水CeCl3,则应考虑抑制CeCl3水解.
解答 解:(1)①Fe元素化合价部分由+2价升高到+3价,S元素化合价由-1价升高到0价,C元素化合价由0价升高到+2,3FeS2~Fe3O4~2e-,2C~2CO~4e-,
3FeS2~6S~6e-,O2~2O~4e-,电子转移总数为12,氧气分子式前系数为3,原子守恒配平书写得到化学方程式:3FeS2+2 C+3O2=Fe3O4+2CO+6S,从化学方程式可看出Fe、S、C三种元素的化合价均升高,所以被氧化的物质为FeS2和C,生成3mol硫时,被氧化的FeS2为1.5mol,被氧化的C为6mol硫,共7.5mol,电子转移为1.5molO2得到电子=1.5mol×4=6mol,
故答案为:3FeS2+2 C+3O2=Fe3O4+2CO+6S,6mol;
②FeS2为离子化合物,亚铁离子和过硫根离子构成,电子式为: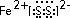 ,故答案为:
,故答案为: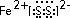
(2)①已知CuO、MnO2、Fe2O3对过氧化氢分解的催化作用,过氧化氢和都含有过氧键,则过硫酸钾分解时,也可用CuO、MnO2、Fe2O3作催化剂,
故答案为:ABC;
②硫酸锰(MnSO4)和过硫酸钾两种盐溶液在催化剂存在下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸,由质量守恒可知一定有水参加反应,反应的方程式为8H2O+2MnSO4+5K2S2O8=2KMnO4+4K2SO4+8H2SO4,
故答案为:8H2O+2MnSO4+5K2S2O8=2KMnO4+4K2SO4+8H2SO4;
③K2S2O8 氧化性比KMnO4强,可把Cl-氧化为氯气,故生成物还有氯气,故答案为:氯气;
(3)为抑制CeCl3水解,CeCl3•6H2O应在氯化氢气氛中加热除去结晶水制备无水CeCl3,故答案为:在通入氯化氢气体的条件下加热除去结晶水.
点评 本题主要考查氧化还原反应及其配平、化学方程式的书写、盐的水解,为高频考点,侧重于学生的分析能力考查,注意把握题给信息,答题时注意审题,难度中等.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
| A. | 一定含甲烷 | B. | 一定有乙烷 | ||
| C. | 一定是甲烷和乙烯的混合气体 | D. | 一定是甲烷和丙炔的混合气体 |
| A. | 酒精及其他易燃物小面积失火,应该迅速使用湿抹布扑盖;钠、钾等失火应用泡沫灭火器扑灭 | |
| B. | 用排水法收集气体时,先撤酒精灯后移出导管 | |
| C. | 少量氢氧化钠溶液沾在皮肤上,立即用水冲洗,再涂碳酸氢钠溶液 | |
| D. | 有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑 |
| A. | 3:1:2:2 | B. | 1:3:2:2 | C. | 1:3:2:1 | D. | 1:1:1:1 |
| A. | 6种 | B. | 4种 | C. | 3种 | D. | 2种 |
| A. | 等量的硫蒸气和硫固体分别完全燃烧,前者反应速率快,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+1.9 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H1=-57.3 kJ•mol-1,若含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液的反应热为△H2,则△H1>△H2 | |
| D. | 在101 kPa时,10g H2完全燃烧生成液态水,放出1429 kJ热量,氢气燃烧热的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-517.6 kJ•mol-1 |
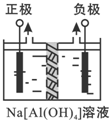 Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题:
Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题: