题目内容
17.A、B、C、D四种强电解质溶液分别含有下列阴、阳离子中的各一种且不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-已知:①向A或D中滴入C,均有沉淀生成:
②向A和B中分别滴加D(可加热)均有气体生成,且这两种气体在水中能反应生成D.
试回答下列问题:
(1)写出A、B、C、D四种溶液中溶质的化学式:
AH2SO4,BNaOH,CBa(NO3)2,D(NH4)2CO3.
(2)D和B反应生成气体,该气体能被足量的A吸收,写出该过程中发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H20、NH3+H+=NH4+.
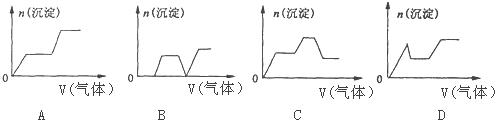
(3)将A与D反应生成的气体缓慢通入含KOH、Ca(OH)2、NaA1O2的混合溶液中,生成沉淀的物质的量n与通入气体的体积V的关系可表示为C(填字母).
分析 (1)解答题目的关键是找到突破口.D和A、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,故D只能为(NH4)2CO3;在A或D中滴入C,均有沉淀生成,说明A中含有SO42-,C中应含有Ba2+,而A和D反应生成的气体说明A一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,所以C是硝酸钡,B是氢氧化钠,以此解答该题;
(2)铵根离子和氢氧根离子共热反应生成氨气,氨气可以和酸反应生成铵盐;
(3)只要通入CO2,立刻就有沉淀CaCO3产生;将Ca(OH)2消耗完毕,接下来消耗KOH,因而此段不会产生沉淀(即沉淀的量保持不变);KOH被消耗完毕,接下来消耗KAlO2,有Al(OH)3沉淀生成;又因二氧化碳足量,还可以继续与上面反应的产物K2CO3、CaCO3、发生反应.
解答 解:(1)以上离子中可能生成的气体有NH3和CO2两种,由D和A、B反应生成,则D中含有CO32-和NH4+离子,应为(NH4)2CO3,
在A或D中滴入C,均有沉淀生成,说明A中含有SO42-,C中应含有Ba2+,而A和D反应生成的气体说明A一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,所以C是硝酸钡,B是氢氧化钠,
故答案为:H2SO4;NaOH;Ba(NO3)2;(NH4)2CO3;
(2)D和B反应生成的气体为NH3,反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H20,能被H2SO4吸收,反应的离子方程式为NH3+H+=NH4+,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H20、NH3+H+=NH4+.
(3)将二氧化碳气体通入含有氢氧化钾,氢氧化钙,KAlO2的混合溶液中,生成沉淀的量和通入二氧化碳的量的关系以二氧化碳的体积为横坐标,以沉淀的物质的量为纵坐标的图象的画法,可以做如下分析:
CO2先与Ca(OH)2反应(有沉淀CaCO3生成);当Ca(OH)2消耗完毕后再与KOH反应(此时无沉淀);最后与KAlO2反应(有沉淀Al(OH)3生成).到现在的图标应是出现沉淀(CaCO3),平台,沉淀增加[因有Al(OH)3生成];
过量的CO2还可以继续与K2CO3反应得到KHCO3,继续过量的CO2还可以使CaCO3沉淀溶解.最后是Al(OH)3沉淀.
图形应该是:出现沉淀(CaCO3),平台,沉淀增加[Al(OH)3],平台,沉淀减少(CaCO3溶解).
故答案为:C.
点评 本题考查离子的检验和推断,题目难度中等,注意解答题目的关键是找到突破口,而本题的突破口为D和A、B都能生成气体.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | CH3CH2CHO | B. | OHCCH(OH)CH2OH | ||
| C. | 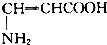 | D. | 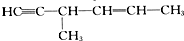 |
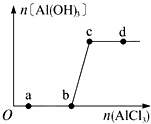 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Fe3+、SO4-、HCO3- | |
| B. | b点对应的溶液中:Na+、S2-、SO42-、Cl- | |
| C. | c点对应的溶液中:Ag+、Ca2+、NO3-、F- | |
| D. | d点对应的溶液中:K+、NH4+、CO32-、I- |
| A. | 等量的硫蒸气和硫固体分别完全燃烧,前者反应速率快,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+1.9 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H1=-57.3 kJ•mol-1,若含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液的反应热为△H2,则△H1>△H2 | |
| D. | 在101 kPa时,10g H2完全燃烧生成液态水,放出1429 kJ热量,氢气燃烧热的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-517.6 kJ•mol-1 |
| A. | NaCl溶液(BaCl2):加Na2SO4溶液,过滤 | |
| B. | NaCl溶液(I2):加酒精,萃取 | |
| C. | KNO3溶液(AgNO3):加NaCl溶液,过滤 | |
| D. | KNO3溶液(I2):加CCl4,萃取 |
试管编号 实验步骤 | 1 | 2 | 3 | 4 |
| 1%NaCl溶液(mL) | 1 | |||
| 1% CuSO4溶液(mL) | 1 | |||
| 1% Na2SO4溶液(mL) | 1 | |||
| 蒸馏水(mL) | 1 | |||
| pH6.8缓冲液(mL) | 1 | 1 | 1 | 1 |
| 1%淀粉溶液(mL) | 1 | 1 | 1 | 1 |
| 唾液淀粉酶液(mL) | 1 | 1 | 1 | 1 |
| 各试管放入37℃恒温水浴保温适宜时间 | ||||
| 取出试管,加入1%碘溶液0.1mL | ||||
| 观察结果 | 无色 | 深蓝色 | 浅蓝色 | |
(2)实验中加入缓冲液的作用是维持反应液中pH的稳定.
(3)分析实验结果可知:对酶活性有影响的离子是Cl-和Cu2+,其中对酶活性有抑制作用的离子是Cu2+,对酶活性有促进作用的离子是Cl-.
(4)该实验中设置4号试管的目的是对照;设置3号试管的目的是确定Na+和SO42-对唾液淀粉酶催化活性是否有影响.
(5)上述实验中若用斐林试剂代替碘溶液进行检测,1~4号试管中的颜色依次是深砖红色、蓝色、浅砖红色、浅砖红色.根据上述实验结果,在操作过程中,保温之前不能先加入斐林试剂,其原因是斐林试剂中有Cu2+,有可能抑制唾液淀粉酶的活性.
| A. | 向NaHSO4溶液中滴加Ba(OH)2至SO42-沉淀完全:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 碳酸钠溶液与醋酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | 氢氧化亚铁与硝酸混合:Fe(OH)2+2H+=Fe2++2H2O | |
| D. | 将1~2mL氯化铁饱和溶液加到20mL沸水中:Fe3++3H2O?Fe(OH)3(胶体)+3H+ |

 $\stackrel{KMnO_{4}(H)}{→}$
$\stackrel{KMnO_{4}(H)}{→}$
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$  (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化) .
. .
. .
.