题目内容
4.生活处处有化学.下列说法正确的是( )| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| D. | 施肥时,草木灰(有效成分为K2CO3)和NH4Cl混合使用,会产生氨气降低肥效 |
分析 A.棉和麻主要成分是纤维素;
B.花生油是植物油,是不饱和酯类;
C.蛋白质要在催化剂作用下才能水解为氨基酸;
D.草木灰中碳酸钾溶液中水解显碱性,氯化铵溶液中铵根离子水解显酸性,二者混合水解相互促进损失肥效.
解答 解:A.棉和麻主要成分是纤维素,与淀粉不属于同分异构体,n值不同,故A错误;
B.花生油是不饱和酯类,牛油是饱和酯类,故B错误;
C.豆浆煮沸是蛋白质发生了变性,故C错误;
D.施肥时草木灰(有效成分为K2CO3)与NH4Cl混合使用,则二者的水解作用相互促进,使N元素以氨气的形式逸出因而肥效会降低,故D正确.
故选D.
点评 本题考查了同分异构体的判断、有机物结构与性质等知识,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况.

练习册系列答案
相关题目
14.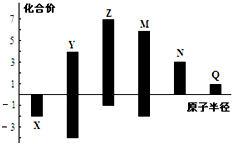 X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )
X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )
 X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )
X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>Y>X |
15.利用下列实验装置进行的相应实验,能达到实验目的是( )
| A. |  所示装置可制备氨气 | |
| B. |  所示装置可分离CH3CH2OH和CH3COOC2H5的混合液 | |
| C. |  所示装置可制备、收集乙烯并验证其易被氧化 | |
| D. |  所示装置可制取乙酸乙酯 |
9. 一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )
一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )
 一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )
一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )| A. | 放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| B. | 放电时OH-移向镍电极 | |
| C. | 充电时碳电极反应为H2-2e-+2OH-=2H2O | |
| D. | 充电时将碳电极与电源的正极相连 |
16.硅是重要的半导体材料,构成了现代电子工业的基础.回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
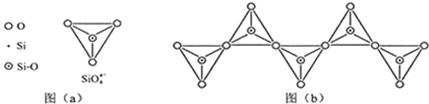
(6)在硅酸盐中,SiO44-四面体(如图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3.
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C一O | Si-Si | Si-H | Si一O |
| 键能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3.

13.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | pH=2的盐酸溶液中含有的阳离子数为0.02NA | |
| B. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| C. | 标准状况下,22.4L CHCl3所含有的分子数目为NA | |
| D. | 27g铝与足量的盐酸或NaOH溶液反应转移的电子数目均为3NA |
10.相同质量的下列各组混合气体完全燃烧,比等质量的乙烯耗氧量多的是( )
| A. | 甲烷和丙烯 | B. | 丙烯和丁烯 | C. | 环丙烷与丙烯 | D. | 丙烯与丙炔 |
