题目内容
7.对下表中实验操作或现象的解释不合理的是( )| 实验操作及现象 | 现象的解释 | |
| A | 将一片铝箔置于酒精灯外焰上灼烧,铝箔熔化但不滴落 | 单质铝的熔点特别高 |
| B | 用玻璃尖嘴导管导出氢气,点燃,观察到火焰呈黄色 | 普通玻璃中含有钠元素 |
| C | 往水中加入Na2O2固体,滴入酚酞呈红色,振荡,红色褪去 | 产生了碱性物质,且Na2O2具有漂白性 |
| D | 向过量的苯酚浓溶液中滴加少许饱和溴水,振荡,未观察到白色沉淀产生 | 三溴苯酚溶解在过量的苯酚中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氧化铝的熔点高,包裹在Al的外面;
B.黄色火焰为钠元素的性质;
C.过氧化钠与水反应生成氢氧化钠;
D.三溴苯酚易溶于苯酚.
解答 解:A.将一片铝箔置于酒精灯外焰上灼烧生成氧化铝,氧化铝的熔点高,包裹在Al的外面,则铝箔熔化但不滴落,故A错误;
B.黄色火焰为钠元素的性质,说明玻璃中含有钠元素,故B正确;
C.过氧化钠与水反应生成氢氧化钠,呈碱性,酚酞呈红色,过氧化钠有漂白性,能使酚酞褪色,故C正确;
D.三溴苯酚易溶于苯酚,观察不到白色沉淀,故D正确.
故选A.
点评 本题考查化学实验方案的评价,涉及物质的性质以及元素的检验等知识点,侧重物质性质的考查,选项D为易错点,题目难度中等.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
17.已知草酸为二元中强酸,具有较强还原性,且Ka2(H2C2O4)>Ka(HClO),下列说法正确的是( )
| A. | 草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+)=c(HC2O4-)+c(C2O42-) | |
| B. | NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-=HClO+C2O42- | |
| C. | (NH4)2C2O4溶液中:c(NH4+)=2 c(H2C2O4)+2 c(HC2O4-)+2 c(C2O42-) | |
| D. | 草酸使酸性KMnO4溶液褪色,离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |
18.O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点.O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力.常温常压下发生反应如下:
反应①O3?O2+[O]△H>0 平衡常数为K1;
反应②[O]+O3?2O2△H<0 平衡常数为K2;
总反应:2O3?3O2△H<0 平衡常数为K
下列叙述正确的是( )
反应①O3?O2+[O]△H>0 平衡常数为K1;
反应②[O]+O3?2O2△H<0 平衡常数为K2;
总反应:2O3?3O2△H<0 平衡常数为K
下列叙述正确的是( )
| A. | 升高温度,K增大 | B. | K=K1+K2 | ||
| C. | 适当升温,可提高消毒效率 | D. | 压强增大,K2减小 |
15.利用下列实验装置进行的相应实验,能达到实验目的是( )
| A. |  所示装置可制备氨气 | |
| B. |  所示装置可分离CH3CH2OH和CH3COOC2H5的混合液 | |
| C. |  所示装置可制备、收集乙烯并验证其易被氧化 | |
| D. |  所示装置可制取乙酸乙酯 |
2.化学与社会、生活密切相关,下列说法正确的是( )
| A. | Fe3O4俗称铁红,常做红色油漆和涂料 | |
| B. | 燃料电池的燃料都在负极发生氧化反应 | |
| C. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
16.硅是重要的半导体材料,构成了现代电子工业的基础.回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3.
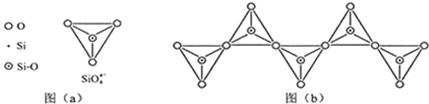
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C一O | Si-Si | Si-H | Si一O |
| 键能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3.

17.下列有关(NH4)2Fe(SO4)2溶液的叙述正确的是( )
| A. | 该溶液中,K+、Mg2+、NH3•H2O、Cl-可以大量共存 | |
| B. | 与足量Ba(OH)2溶液反应的离子方裎式:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ | |
| C. | (NH4)2Fe(SO4)2溶液久置空气中变质的离子方程式:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+ | |
| D. | 向该溶液中滴加适量的酸性KMnO4溶液使其恰好反应溶液褪为无色 |
