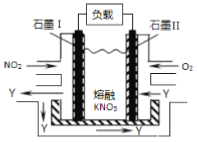
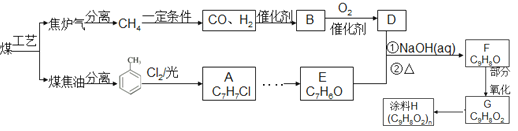
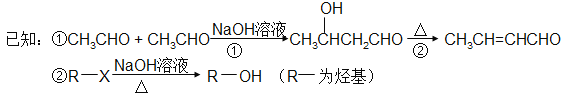
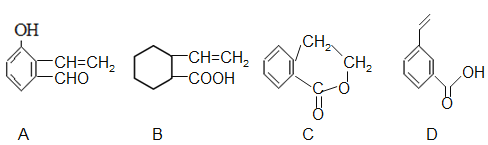
题目内容
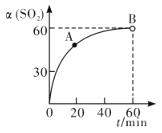
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达到平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A. 由图甲知,A点SO2的平衡浓度为0.4 mol·L-1
B. 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C. 达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D. 压强为0.50 MPa时,不同温度下SO2转化率与温度关系如丙图,则T2>T1
【答案】C
【解析】试题分析:A项:因反应容器的体积可变,A点时容器体积会变小,A点SO2的平衡浓度要大于0.04 mol/L,故错;B项:因反应容器的体积可变,B点时容器体积变小,B点SO2、O2、SO3的平衡浓度不一定为2∶1∶2,故错;D项:SO2的转化率增大,平衡逆向移动,正反应为放热反应,温度应降低,则T2<T1,故错。故选C。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
A | 基态原子最外层电子数是次外层的三倍 |
B | 基态原子核外有13种不同运动状态的电子 |
C | 与B同一周期,原子中未成对电子数是同周期中最多 |
D | D2-的核外电子排布与氩原子相同 |
E | 是ds区原子序数最小的元素 |
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:____________(用相应的元素符号表示).A、D两种元素中,电负性A____________D (填“>”或“<”)
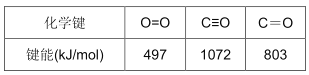
(2)A3分子的空间构型为____________,与其互为等电子体的分子为____________;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:____________,C7H15OH 中采用sp3杂化的原子共有____________个;
(4)E(NH3)42+配离子中存在的化学键类型有____________(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若 E(NH3)42+具有对称的空间构型.且当 E(NH3)42+中的两个NH3分子被两个Cl一取代时。能得到两种不同结构的产物,则 E(NH3)42+的空间构型为____________(填序号)。
a.平面正方形b.正四面体 c.三角锥形 d.V形
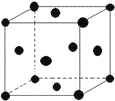
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式____________(用M、r、ρ表示)。