��Ŀ����
����Ŀ���������ƣ�NaNO2����һ�ֳ�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ������������ij��ȤС���������ʵ��̽������������֪������2NO+Na2O2=2NaNO2 ��2NO2+Na2O2=2NaNO3������KMnO4��Һ�ɽ�NO2������ΪNO3����MnO4����ԭ��Mn2+��
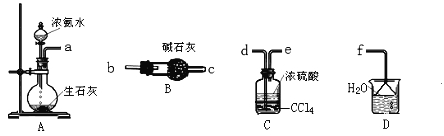
��Ʒ�Ʊ�����飺����ͼ1װ���Ʊ�NaNO2��
��1��д��װ��A��ƿ�з�����Ӧ�Ļ�ѧ����ʽ���������ת�Ƶķ������Ŀ__________
��2��Bװ�õ�������_______
��3����ͬѧ��Ϊװ��C�в��ﲻ�����������ƣ����������ơ�̼���ơ��������ƣ�Ϊ�Ʊ�����NaNO2Ӧ��B��Cװ�ü�����һ��װ�ã������ҿ��ڻ������ӵ�װ��ͼ2��������ʢ�ŵ��Լ���
��4�������ʵ�����װ��C��NaNO2�Ĵ��ڣ�д������������ͽ��ۣ�_____________________
�����IJⶨ
��ȡװ��C�з�Ӧ��Ĺ���4.00g����ˮ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У���0.1000mol/L����KMnO4��Һ���еζ���ʵ�������������±���ʾ��
![]()
��5����һ��ʵ�����ݳ����쳣����������쳣��ԭ�������________��˫��ѡ��
A����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ
B����ƿϴ����δ����
C���ζ��������Ӷ���
D���ζ��������Ӷ���
��6�����ݱ������ݣ��������ù������������Ƶ���������________���������4λ��Ч���֣�
���𰸡� ��1��![]()
��2�� ��NO2ת��ΪNO��ͬʱCu��ϡ���ᷴӦ����NO������ȡNO��
��3�� ��
��![]() ��
��
��4��ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ⣬������ϡ�����ữ���μ���1��2�Σ�����������KMnO4��Һ������Һ��ɫ��ȥ��˵��C�в��ﺬ��NaNO2
��5��AC
��6��86.25%��0.8625
��������
�����������1��C��Ũ���ᷴӦ����NO2��CO2��ˮ��̼Ԫ�صĻ��ϼ���0�����ߵ�+4�ۣ���NԪ�صĻ��ϼ���+5�۽��͵�+4�ۣ����ݻ��ϼ�������ȣ�������Ӧ�Ļ�ѧ����ʽ������ת�Ƶķ������ĿΪ��
![]() ��
��
��2��������Ϣ��֪��Ҫ�Ʊ�NaNO2��Ҫ��Ӧ��NO������Bװ�õ������ǽ�NO2ת��ΪNO��ͬʱCu��ϡ���ᷴӦ����NO������ȡNO����
��3���Ʊ�����NaNO2����Ҫ��ȥ��������ˮ��������̼����ʵ��װ��Ϊ��3��![]() ��
��![]() ��
��
��4��ȡ����װ��C�в��������Թ��У�������������ˮ�ܽ⣬������ϡ�����ữ���μ���1��2�Σ�����������KMnO4��Һ������Һ��ɫ��ȥ��˵��C�в��ﺬ��NaNO2.
��5��A. ��ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ���������ı�Һ�����ƫ�������¸������Ũ��ƫ�ͣ������õ����ƫ��B. ��ƿϴ����δ����Բⶨ�����Ӱ�죻C. �ζ��������Ӷ���������ĩ���������������������������ĵ����ƫ��D. �ζ��������Ӷ���������ĩ�����ݼ�С�������ֵ��С������������ĵ����ƫС����ѡAC��
��6���������ݿɵ�KMnO4��Һ��ƽ�����Ϊ20mL�����ݵ�ʧ�����غ㣬2MnO4-��5NO2-������m��NaNO2��=0.02L��0.1mol/L��10��5/2��69=3.45g��������������Ϊ3.45��4��100%=86.25%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�