题目内容
【题目】今年,雾霾阴影笼罩全国。二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容。
(1)汽车尾气中的 NO(g)和CO(g)在一定温度和催化剂的条件下可净化。发生的反应如下:2NO(g)+2CO(g)![]() 2CO2 (g)+N2 (g)
2CO2 (g)+N2 (g)
①已知:N2(g)+O2 (g)=2NO(g) ΔH=+180.0 kJ/mol。部分化学键的键能如下(键能指气态原子形成1mol化学键释放的最小能量)

则反应:2NO(g)+2CO(g)![]() 2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
2CO2 (g)+N2 (g) ΔH=__________ kJ/mol
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是__________(填选项序号)。(图中 ω、M、v 正 分别表示质量分数、混合气体平均相对分子质量、正反应速率)

(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸。已知:2SO2(g)+O2 (g)![]() 2SO3(g) ΔH=-196.0 kJ/mol。
2SO3(g) ΔH=-196.0 kJ/mol。
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图所示:

则A点的v逆(SO2 )__________(填―大于‖、―小于‖或―等于‖)B 点的 v正(SO2)。
②在某温度时,向10L的密闭容器中加入4.0 molSO2和10.0 molO2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是______(填选项序号)。
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0 mol SO2和5.0 mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)利用电化学原理,将NO2、O2和熔融KNO3 制成燃料电池,其原理如下图所示。

该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用。石墨Ⅱ是电池的____极,石墨Ⅰ附近发生的电极反应式为________________________。相同条件下,消耗的O2和NO2的体积比为_____。
(4)尾气中氮氧化物(NO和NO2 )也可用尿素[CO(NH2)2 ]溶液除去,反应生成对大气无污染的气体。1 mol 尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1∶1)的质量为___________g。
【答案】(1) ①-751.0; ②BC;
(2) ①小于;②BC ;
(3) ① 正; ②NO2+ NO3- - e - = N2O5; ③1︰4;(4) 76;
【解析】
试题分析:(1)①化学反应的实质是旧化学键的断裂和新化学键的形成。根据题中给出的部分化学键的键能可得:2CO(g)+O2(g)=CO2(g) ΔH=(2×1072+497)-4×803=-571 kJ/mol,又已知 N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol,根据盖斯定律可知:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-571.0kJ/mol– (+180.0kJ/mol)= -751.0kJ/mol;
2CO2(g)+N2(g) ΔH=-571.0kJ/mol– (+180.0kJ/mol)= -751.0kJ/mol;
②根据①的结论,正反应为放热反应。在绝热、恒容的密闭体系中,随着反应的进行,反应物不断消耗,NO 的浓度逐渐减小,平衡时NO的质量分数保持不变,A 图正确;该反应的正反应气体分子数减小,随着反应的进行,气体总的物质的量减小,根据 M=m/n 可知混合气体的平均摩尔质量(M)逐渐增大,平衡后 M 不再变化,B 图错;随着反应的进行,从温度来看,温度不断升高,反应速率加快,从反应物的浓度来看,反应物不断消耗,反应速率减小,C 图中在 t1 时刻,正反应速率达到最大值,说明 t1 时刻之前反应速率主要受温度影响,t1 时刻之后随着反应物浓度的减小,正反应速率逐渐减小,直至达到平衡,所以 t1 时刻不是化学平衡时刻,C 图错。故选项 B、C 符合题意。
(2)①在一定温度的密闭容器中,SO2的转化率随时间的变化而增大,由图像可知,A 点过后,SO2的转化率任然增大,说明平衡正向移动,则A点时v逆(SO2)小于v正(SO2),B点时可逆反应达到平衡,则 B 点时v逆(SO2)等于B点的v正(SO2),而B点时v逆(SO2)大于A点时v逆(SO2)(平衡正向移动,逆反应速率逐渐增大),故A点的 v逆(SO2)小于B点的v正(SO2)。
②A.在其他条件不变时,减小容器的容积,氧气的浓度增大,虽然平衡正向移动,但是达到新的平衡,氧气的浓度仍比原来的浓度大,A 项不选;B.保持温度和容器内压强不变,再充入 2.0 mol SO 2 和 5.0 mol O 2 与原平衡属于等效平衡状态,浓度不变,B 项正确;C.保持温度和容器体积不变,再充入 SO2 和 SO3 ,使之浓度扩大为原来的两倍,根据Q=[2c(SO3)]2÷{[2c(SO2)]2×c(O2 )}= [c(SO3 )]2÷{[c(SO2)]2×c(O2)}=K,平移不移动,氧气的浓度不变,C 项正确;故选项 B、C 符合题意。
(3)利用电化学原理,将 NO2、O2和熔融 KNO 3 制成燃料电池,其总反应方程式为:4NO2 +O2=2N2O5,根据原理示意图可知,石墨Ⅱ(通入O2的电极)为正极;硝化剂 Y(Y 是一种氧化物)为 N2O5,熔融电解质中的NO3 - 向负极(石墨Ⅰ)移动,故 NO2、NO3-在负极反应生成N2O5 ,其电极反应方程式为NO2+ NO3-- e- = N2O5。
(4)由题目信息可知,NO、NO2与尿素[CO(NH2)2]反应生成 CO2、N2和 H2O,其反应方程式为 NO+NO2+CO(NH2)2 = CO2↑+2N2↑+2H2O,所以:
(NO+NO2) ~ CO(NH2)2
(30+46)g 1mol
故1mol尿素能吸收工业尾气中氮氧化物(假设 NO、NO2体积比为 1∶1)的质量为76g。

 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
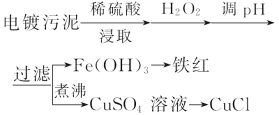
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 2.3 | 7.6 | 4.4 |
完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(1)酸浸后加入H2O2的目的是 。调pH步骤中加入的试剂最好是 (填化学式)。实验室进行过滤操作所用到的玻璃仪器有 、 、 。
(2)煮沸CuSO4溶液的原因是 。向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式 。
(3)Fe3+发生水解反应Fe3++3H2O![]() Fe(OH)3+3H+,该反应的平衡常数表达式为 。
Fe(OH)3+3H+,该反应的平衡常数表达式为 。
(4)称取所制备的CuCl样品0.250 0 g置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00 mL。有关的化学反应为Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+。计算该CuCl样品的质量分数 。