题目内容
11.下表为元素周期表的一部分.
请回答:
(1)五种元素中原子半径最大的是Y>Z>Q>W>X(填元素符号).
(2)X2、W2都能与H2反应生成氢化物,用原子结构解释原因卤素原子的最外层电子数均为7;X与W相应的氢化物的稳定性HF>HCl(填化学式).
(3)五种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(4)Z与Y 两种元素的最高价氧化物的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)X、Q、W非金属性比较:F>Cl>S(填元素符号);用原子结构解释原因原子半径S>Cl>F,所以原子核对最外层电子的吸引力:S<Cl<F,得电子能力:F>Cl>S,则非金属性:F>Cl>S.
分析 由元素在周期表中的位置可知,X为F,Y为Na,Z为Al,Q为S,W为Cl,
(1)电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小;
(2)F、Cl原子的最外层电子数均为7,只要形成一对共用电子对,达稳定结构;非金属性越强,对应氢化物的稳定性越强;
(3)非金属性越强,最高价氧化物对应水化物的酸性越强,不过F没有正价,酸性最强的为高氯酸;
(4)氢氧化铝和NaOH反应生成偏铝酸钠和水,据此写出反应的离子方程式;
(5)原子半径越小,得电子能力越强,非金属性越强,据此进行分析.
解答 解:由元素在周期表中的位置可知,X为F,Y为Na,Z为Al,Q为S,W为Cl,
(1)Y、Z、Q、W比X原子多1个电子层,则X的原子半径最小;Y、Z、Q、W的电子层相同,核电荷数越大,原子半径越小,则五种元素的原子半径大小为:Y>Z>Q>W>X,
故答案为:Y>Z>Q>W>X;
(2)F、Cl原子的最外层电子数均为7,只要形成一对共用电子对就达稳定结构;
F的非金属性对应Cl,则氟化氢的稳定性大于氯化氢,即:HF>HCl,
故答案为:卤素原子的最外层电子数均为7;HF;HCl;
(3)非金属性越强,最高价氧化物对应的水化物的酸性越强,F没有正价,则其它元素中非金属性最强的为Cl,则酸性最强的为高氯酸:HClO4,
故答案为:HClO4;
(4)Z与Y两种元素的最高价氧化物的水化物分别为氢氧化铝和氢氧化钠,氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:OH-+Al(OH)3=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)由于原子半径S>Cl>F,所以原子核对最外层电子的吸引力:S<Cl<F,得电子能力:F>Cl>S,则非金属性:F>Cl>S,
故答案为:F;Cl;Cl;原子半径S>Cl>F,所以原子核对最外层电子的吸引力:S<Cl<F,得电子能力:F>Cl>S,则非金属性:F>Cl>S.
点评 本题考查元素周期表和元素周期律的综合应用,题目难度中等,明确元素的位置推断出元素是解答的关键,注意元素周期律的应用和化学用语的规范化.

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 用pH试纸测得某新制氯水的pH为2 | |
| C. | 有单质生成的反应一定为氧化还原反应 | |
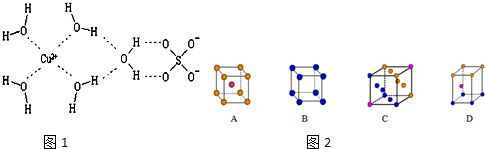
| D. | CuSO4•5H2O是一种混合物 |
| A. | A的转化率变大 | B. | 平衡向逆反应方向移动 | ||
| C. | C的体积分数变大 | D. | a>c+d |
| A. | 所有主族元素原子的最外层电子数都等于元素的最高正化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 第IA族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
| A. | ${\;}_{92}^{235}$U和${\;}_{53}^{131}$I是同位素 | |
| B. | ${\;}_{53}^{131}$I的质子数为131 | |
| C. | ${\;}_{92}^{235}$U的中子数是143 | |
| D. | ${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs是同种元素 |
| A. | 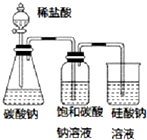 图中的实验现象能证明非金属性:Cl>C>Si | |
| B. | 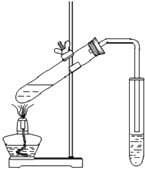 图可用于实验室制备并收集乙酸乙酯 | |
| C. |  图中,气体从a口进入时,可用于收集H2、CH4、NH3等气体 | |
| D. | 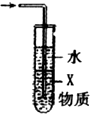 图中X若为CCl4,可用于吸收NH3或HCl |
| A. | Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA | |
| B. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA | |
| D. | 1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |