题目内容
3.科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图如图1可简单表示如下,其中配位键和氢键均采用虚线表示.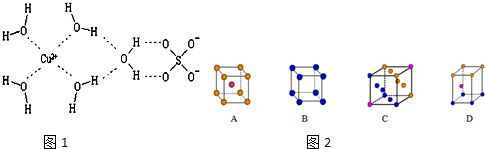
(1)金属铜采用下列C堆积方式.
(2)Cu2+还能与NH3、Cl-等形成配位数为4的配合物.
①[Cu(NH3)4]2+中存在的化学键类型有AC(填序号).
A.配位键 B.离子键 C.极性共价键 D.非极性共价键
②元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为3:1;
(3)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色溶液.写出此蓝色沉淀溶解的离子方程式:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O
(4)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成血红色.该反应在有的教材中用方程式FeCl3+3KSCN═Fe(SCN)3+3KCl表示.经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合.请按要求填空:
①Fe3+与SCN-反应时,Fe3+提供空轨道,SCN-提供孤对电子,二者通过配位键结合.
②所得Fe3+与SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色.含该离子的配合物的化学式是[Fe(SCN)]Cl2.
分析 (1)Cu为最密堆积,配位数为12,据此进行判断;
(2)①配离子[Cu(NH3)4]2+中含有配位键,不同非金属元素之间形成极性共价键;
②根据均摊法计算晶胞中Cu、Au原子数目,确定合金中二者原子数目之比;
(3)硫酸铜先和氨水反应生成氢氧化铜沉淀,后氢氧化铜和氨水反应生成络合物;
(4)①形成配位键的条件是中心离子含有空轨道,配体含有孤对电子;
②Fe3+与SCN-以个数比1:1配合所得离子为[Fe(SCN)]2+,据此判断FeCl3与KSCN在水溶液中的反应产物.
解答 解:(1)Cu为最密堆积,其配位数为12,只有C符合,
故答案为:C;
(2)①[Cu(NH3)4]2+中Cu2+与NH3之间的化学键为配位键,N-H为极性共价键,
故答案为:AC;
②铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则晶胞中Cu原子数目=6×$\frac{1}{2}$=3,晶胞中Au原子数目=8×$\frac{1}{8}$=1,故晶胞中Cu原子与Au原子数量之比为3:1,
故答案为:3:1;
(3)氢氧化铜沉淀可以溶于过量的氨水中,反应的离子方程式为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)①Fe3+与SCN-反应生成的配合物中,Fe3+提供空轨道,SCN-提供孤对电子,
故答案为:空轨道,孤对电子;
②Fe3+与SCN-以个数比1:1配合所得离子为[Fe(SCN)]2+,所以FeCl3与KSCN在水溶液中反应生成[Fe(SCN)]Cl2与KCl,
故答案为:[Fe(SCN)]Cl2.
点评 本题考查了配合物的成键情况、晶胞的计算、化学键类型判断等知识,题目难度中等,注意掌握配合物成键及其及化学键类型,明确均摊法在晶胞计算中的应用方法.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 原子半径大小:Na>P>N | B. | 金属性强弱:K>Na>Ca | ||
| C. | 酸性强弱:H2SiO3>H2CO3 | D. | 碱性强弱:LiOH>NaOH>KOH? |
| A. | 蔗糖完全水解的产物 | B. | 蛋白质完全水解的产物 | ||
| C. | 油脂皂化反应后的产物 | D. | 淀粉完全水解后的产物 |
| A. | 乙烯和丙烯 | B. | 甲烷和乙烯 | C. | 甲苯和乙苯 | D. | 乙炔和苯 |


 ;
; ;
; (填结构简式).
(填结构简式).