题目内容
7.市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大.回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如图: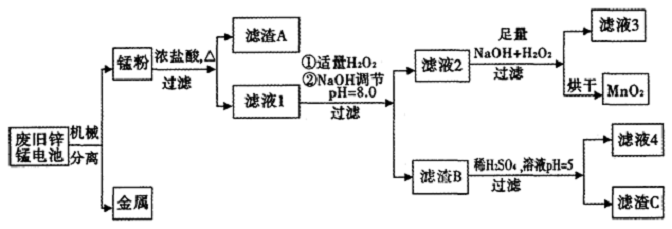
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐.常温下,生成氢氧化物沉淀的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(2)写出滤液2中的Mn2+变成MnO2的离子方程式Mn2++H2O2+2OH-=MnO2↓+2H2O.
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式Zn(OH)2+H2SO4=ZnSO4+2H2O.
(4)工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体.
(5)MnO2常用来制取KMnO4.在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4.电解K2MnO4溶液的总反应方程式为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑.
分析 “锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐,向锰粉中加入浓盐酸并加热,发生反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O、Zn(OH)2+2HCl=ZnCl2+2H2O、Fe+2HCl=FeCl2+H2↑,然后采用过滤方法得到滤渣A和滤液1,滤渣A中含有MnOOH、C,滤液1中含有氯化锰、氯化锌、氯化亚铁等,向滤液中加入少量双氧水,发生反应为Mn2++H2O2+2OH-=MnO2↓+2H2O、Fe2++2H++H2O2=Fe 3++2H2O,加入NaOH溶液调节溶液pH=8.0,根据表中数据知,Fe3+、Zn2+完全沉淀而除去;然后过滤,向滤液2中加入足量NaOH和双氧水,然后过滤得到固体MnO2,
向滤渣B中加入稀硫酸并调节溶液的pH=5,得到的沉淀是Fe(OH)3,Zn(OH)2溶解,过滤得到的滤液4溶液主要成分是硫酸锌,滤渣C是Fe(OH)3,
(1)加入NaOH溶液调节pH=8.0,目的是除去锌、铁离子;常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=c(OH-)2.c(Zn 2+);
(2)滤液2中的Mn2+被双氧水氧化生成MnO2时同时生成水;
(3)滤渣B中氢氧化锌与稀硫酸在pH=5时反应生成硫酸锌和水;
(4)从滤液中得到晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法;
(5)电解K2MnO4溶液时,阳极上锰酸根离子失电子发生氧化反应、阴极上氢离子放电生成氢气.
解答 解:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐,向锰粉中加入浓盐酸并加热,发生反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O、Zn(OH)2+2HCl=ZnCl2+2H2O、Fe+2HCl=FeCl2+H2↑,然后采用过滤方法得到滤渣A和滤液1,滤渣A中含有MnOOH、C,滤液1中含有氯化锰、氯化锌、氯化亚铁等,向滤液中加入少量双氧水,发生反应为Mn2++H2O2+2OH-=MnO2↓+2H2O、Fe2++2H++H2O2=Fe 3++2H2O,加入NaOH溶液调节溶液pH=8.0,根据表中数据知,Fe3+、Zn2+完全沉淀而除去;然后过滤,向滤液2中加入足量NaOH和双氧水,然后过滤得到固体MnO2;
向滤渣B中加入稀硫酸并调节溶液的pH=5,得到的沉淀是Fe(OH)3,Zn(OH)2溶解,过滤得到的滤液4溶液主要成分是硫酸锌,滤渣C是Fe(OH)3,
(1)根据表中数据知,加入NaOH溶液调节pH=8.0,铁离子和锌离子都转化为氢氧化物沉淀,所以目的是使Fe3+、Zn2+完全沉淀而除去;
常温下c(OH-)=10-6 mol/L,c(Zn 2+)=10-5 mol/L,所以Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=c(OH-)2.c(Zn 2+)=(10-6)2.10-5=1.0×10-17,
故答案为:使Fe3+、Zn2+完全沉淀而除去; 1.0×10-17;
(2)滤液2中的Mn2+被双氧水氧化生成MnO2时同时生成水,离子反应方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,
故答案为:Mn2++H2O2+2OH-=MnO2↓+2H2O;
(3)滤渣B中氢氧化锌与稀硫酸在pH=5时反应生成硫酸锌和水,反应方程式为Zn(OH)2+H2SO4=ZnSO4+2H2O,
故答案为:Zn(OH)2+H2SO4=ZnSO4+2H2O;
(4)从滤液中得到晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,所以工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体,
故答案为:蒸发浓缩;冷却结晶;过滤;
(5)电解K2MnO4溶液时,阳极上锰酸根离子失电子发生氧化反应、阴极上氢离子放电生成氢气,
电池反应式为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑,故答案为:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑.
点评 本题考查混合物的分离和提纯,为高频考点,涉及电解原理、离子反应、氧化还原反应、溶度积常数有关计算等知识点,侧重考查基本操作及基本原理,明确实验原理是解本题关键,知道流程图中发生的反应、基本操作,注意(1)中氢氧根离子浓度计算方法,题目难度不大.

| A. | C、O、S | B. | Li、Na、K | C. | Si、P、Cl | D. | F、Cl、Br |
| A. | 升高温度 | B. | 降低温度 | C. | 使用催化剂 | D. | 增大CO浓度 |
固体$\stackrel{稀盐酸}{→}$淡黄色溶液$\stackrel{试剂1}{→}$淡红色溶液$\stackrel{新制氯水}{→}$淡红色溶液$→_{时间后}^{一般}$溶液褪色
(1)固体溶于稀盐酸的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)试剂1的化学式是KSCN;加入试剂1后呈红色的原因是(用离子方程式表示):Fe3++3SCN-=Fe(SCN)3.
(3)加入新制氯水后溶液红色加深的原因是(用化学用语和必要文字解释)2Fe2++Cl2=2Fe3++2Cl-
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?(提示:SCN-中硫元素化合价为-2价)
| 编 号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的+3价Fe被氧化为更高的价态 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 丁 | ? |
| 实验操作 | 预期现象 | 结 论 |
| 说明丁同学的猜想是合理的 |
| A. | XeF4被氧化 | B. | 该反应是非氧化还原反应 | ||
| C. | XeF4既是氧化剂又是还原剂 | D. | CH3-CH=CH2是还原剂 |
| A. | 2molSO2(g)和1molO2(g)所具有的内能小于2molSO3(g)所具有的内能 | |
| B. | 将2molSO2(g)、1molO2(g)置于一密闭容器中充分反应后放出QkJ的热量 | |
| C. | 升高温度,平衡向逆反应移动,上述热化学方程式中的Q值减小 | |
| D. | 如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化 |
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | ⅠA和ⅦA族元素间可形成离子化合物和共价化合物 | |
| C. | 同主族元素的简单阴离子还原性越强,元素非金属性越强 | |
| D. | 同周期金属元素的化合价越高,其金属性越强 |
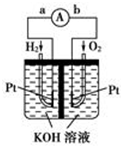 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答: