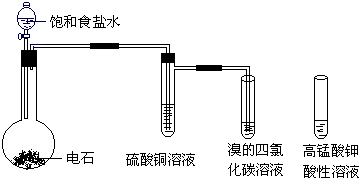
题目内容
2.某同学利用铁与水蒸气反应后的固体物质进行了如下实验:固体$\stackrel{稀盐酸}{→}$淡黄色溶液$\stackrel{试剂1}{→}$淡红色溶液$\stackrel{新制氯水}{→}$淡红色溶液$→_{时间后}^{一般}$溶液褪色
(1)固体溶于稀盐酸的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)试剂1的化学式是KSCN;加入试剂1后呈红色的原因是(用离子方程式表示):Fe3++3SCN-=Fe(SCN)3.
(3)加入新制氯水后溶液红色加深的原因是(用化学用语和必要文字解释)2Fe2++Cl2=2Fe3++2Cl-
(4)某一同学在实验中由于加入了过量新制氯水,放置一段时间后,发现深红色褪去,为了探究溶液褪色的原因,另有四位同学进行了下表的猜想,你认为丁同学的猜想会是什么?(提示:SCN-中硫元素化合价为-2价)
| 编 号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的+3价Fe被氧化为更高的价态 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 丁 | ? |
| 实验操作 | 预期现象 | 结 论 |
| 说明丁同学的猜想是合理的 |
分析 (1)铁与水蒸气反应后的固体为Fe3O4,Fe3O4与HCl反应生成氯化亚铁和氯化铁;
(2)检验三价铁离子用KSCN溶液,二者反应生成Fe(SCN)3;
(3)亚铁离子与氯气反应生成三价铁离子;
(4)溶液中的SCN-被过量的氯水氧化,则溶液会褪色;
取少量褪色后的溶液,加KSCN溶液,看是否变色;
取少量褪色后的溶液,加FeCl3溶液,看是否变色.
解答 解:(1)铁与水蒸气反应后的固体为Fe3O4,Fe3O4与HCl反应生成氯化亚铁和氯化铁,其反应的户型方程式为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
故答案为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
(2)检验三价铁离子用KSCN溶液,二者反应生成Fe(SCN)3,溶液变红色,其反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3;
故答案为:KSCN;Fe3++3SCN-=Fe(SCN)3;
(3)亚铁离子与氯气反应生成三价铁离子,则加入新制氯水后溶液红色加深的原因是2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)溶液中的SCN-被过量的氯水氧化,则溶液会褪色,所以丁同学的猜想是:溶液中的SCN-被过量的氯水氧化;
为验证丁同学的猜想合理与否:取少量褪色后的溶液,加KSCN溶液,如果变红色,说明溶液中的SCN-被过量的氯水氧化,即丁的猜想正确;
取少量褪色后的溶液,加FeCl3溶液,如果不变红色,说明溶液中没有KSCN,即溶液中的SCN-被过量的氯水氧化,即丁的猜想正确,
故答案为:
| 实验操作 | 预期现象 | 说明丁同学的猜想是合理的 |
| 取少量褪色后的溶液,滴加20%KSCN溶液 | 如果溶液变红色 | |
| 或取少量褪色后溶液,加入0,.1mol•L-1FeCl3溶液 | 或如果溶液不变红色 |
点评 本题考查物质的组成的探究实验,把握发生的化学反应及实验操作为解答的关键,侧重分析能力及对基础知识的综合应用能力的考查,注意信息与所学知识的结合,题目难度中等.

| A. | 四氟乙烯 | B. | 碳酸 | C. | 氯仿 | D. | 十六烷 |
| A. | 化学变化都是吸热的 | |
| B. | 化学变化都是放热的 | |
| C. | 化学反应前后反应物和生成物所含能量会发生变化 | |
| D. | 反应物所含能量等于生成物所含能量 |
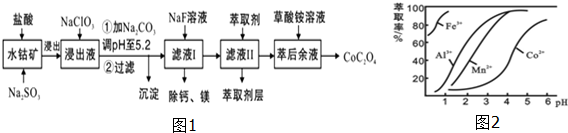
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀.
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示.
滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
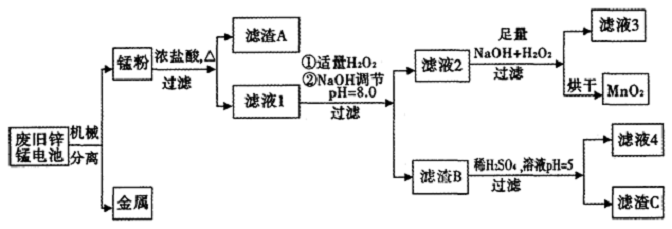
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐.常温下,生成氢氧化物沉淀的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(2)写出滤液2中的Mn2+变成MnO2的离子方程式Mn2++H2O2+2OH-=MnO2↓+2H2O.
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式Zn(OH)2+H2SO4=ZnSO4+2H2O.
(4)工艺中还可以将滤液4进行蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体.
(5)MnO2常用来制取KMnO4.在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4.电解K2MnO4溶液的总反应方程式为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑.

| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜左侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mole-时,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应会改变 |
| A. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C是碳元素的三种核素 | |
| B. | SO2分子中含有离子键 | |
| C. | MgCl2固体中含有共价键 | |
| D. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O含有相同的中子数 |
 .
.
 .
. .
. .
.