题目内容
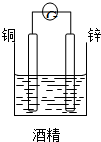
14.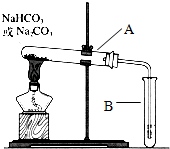 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.(1)提出假设:Na2CO3或NaHCO3加热分解时可能有CO2生成;
(2)设计实验:①利用右图装置分别对一定量的Na2CO3和NaHCO3进行加热;②为了检验CO2的生成,试管B中应加入的物质是紫色石蕊溶液(填“紫色石蕊溶液”或“KOH溶液”);
(3)现象与结论:同学们发现只有在加热NaHCO3时,试管B中才有气泡产生且有红色溶液生成(填溶液的颜色),说明Na2CO3和NaHCO3的热稳定性是:Na2CO3>NaHCO3(填“>”或“<”);
(4)在加热后的A试管中仍留有少量白色固体,冷却后加少量水溶解,再滴加1~2滴酚酞试液,可观察到的现象是溶液呈红色.
(5)某同学在探究NaHCO3的热稳定性时,称取了16.8gNaHCO3,充分加热,请你计算理论上可产生CO2气体的体积为2.24L(标准状况).
分析 (2)为了检验CO2的生成,应利用明显的现象来说明,二氧化碳为酸性氧化物;
(3)只有在加热NaHCO3时,试管B中才有气泡产生,可知分解生成二氧化碳,而碳酸钠不分解;
(4)加热后的A试管中仍留有少量白色固体为碳酸钠,溶于水后水解显碱性;
(5)n(NaHCO3)=$\frac{16.8g}{84g/mol}$=0.2mol,结合2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O及V=nVm计算.
解答 解:(2)若生成二氧化碳,紫色石蕊溶液变红,而二氧化碳与KOH溶液反应现象不明显,则检验气体的生成B中为紫色石蕊溶液,故答案为:紫色石蕊溶液;
(3)只有在加热NaHCO3时,试管B中才有气泡产生,可知分解生成二氧化碳,管B中才有气泡产生且有红色出现,而碳酸钠不分解,可知稳定性为Na2CO3 >NaHCO3,
故答案为:红色;>;
(4)加热后的A试管中仍留有少量白色固体为碳酸钠,溶于水后水解显碱性,再滴加1~2滴酚酞试液,可观察到的现象是溶液呈红色,故答案为:溶液呈红色;
(5)n(NaHCO3)=$\frac{16.8g}{84g/mol}$=0.2mol,由2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O可知,生成气体的物质的量为0.1mol,理论上可产生CO2气体的体积V=nVm=0.1mol×22.4L/mol=2.24L,故答案为:2.24.
点评 本题考查碳酸钠、碳酸氢钠的性质比较,为高频考点,把握碳酸钠、碳酸氢钠的热稳定性大小及发生的反应为解答的关键,侧重分析、实验及计算能力的考查,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
4.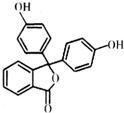 酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
 酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )| A. | 所有原子可能共平面 | |
| B. | 能发生加聚反应生成高分子化合物 | |
| C. | 酚酞的水解产物中含有醇羟基 | |
| D. | 1 mol该物质最多能与含4 mol NaOH的烧碱溶液反应 |
6.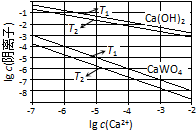 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
(1)图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线.
①计算T1时KSP(CaWO4)=1×10-10.
②T1< T2(填“>”“=”或“<”).
(2)反应Ⅰ的平衡常数K理论值如表:
①该反应平衡常数K的表达式为$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$.
②该反应的△H>0(填“>”“=”或“<”).
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远.50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol•L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42-的沉淀率为60%,计算实验测得的平衡常数.
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高WO42-的沉淀率.
 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).(1)图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线.
①计算T1时KSP(CaWO4)=1×10-10.
②T1< T2(填“>”“=”或“<”).
(2)反应Ⅰ的平衡常数K理论值如表:
| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
②该反应的△H>0(填“>”“=”或“<”).
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远.50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol•L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42-的沉淀率为60%,计算实验测得的平衡常数.
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析其作用:加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高WO42-的沉淀率.
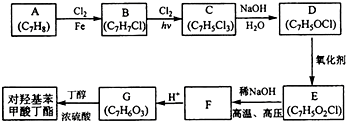
 ;该反应的类型为取代反应.
;该反应的类型为取代反应.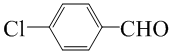 .
.
 前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
 芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯(
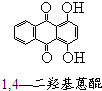
芳香族化合物A(C8H6O4)能与NaHCO3溶液反应生成CO2.由A与对二氯苯(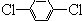 )为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示).
)为原料经多步反应可合成1,4-二羟基蒽醌(结构如图所示).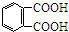 .
.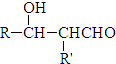 $\stackrel{△}{→}$
$\stackrel{△}{→}$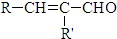
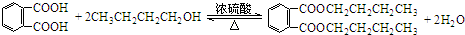 .
.