题目内容
4.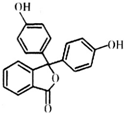 酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )| A. | 所有原子可能共平面 | |
| B. | 能发生加聚反应生成高分子化合物 | |
| C. | 酚酞的水解产物中含有醇羟基 | |
| D. | 1 mol该物质最多能与含4 mol NaOH的烧碱溶液反应 |
分析 该分子中含有苯环、酚羟基、酯基,具有苯、酚和酯的性质,能发生加成反应、还原反应、氧化反应、水解反应、取代反应、中和反应等,据此分析解答.
解答 解:A.连接三个苯环的碳原子具有甲烷碳原子结构,为正四面体结构,所以所有原子不可能共面,故A错误;
B.不含碳碳双键,所以不能发生加聚反应,故B错误;
C.酯基水解后生成羧基和醇羟基,同时该水解产物还有酚羟基,故C正确;
D.酚羟基和酯基水解生成的羧基能和NaOH反应,1 mol该物质最多能与含3 mol NaOH的烧碱溶液反应,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯酚、酯的性质,易错选项是C,注意酯基水解不产生酚羟基但该物质本身含有酚羟基,为易错点.

练习册系列答案
相关题目
14.碳及其化合物的开发利用已成为科学家研究的重要课题,在工农业生产和科学研究中有十分重要的地位.
Ⅰ:草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
(1)在一定温度下向1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=0.04mol•L-1•min-1;当反应达到平衡后,将容器体积压缩为0.5L,一段时间后反应再次达到平衡,则下列说法正确的是CD(填答案选项编号).
A.压缩容器体积,CaC2O4的分解率增大
B.平衡移动后,该反应的化学平衡常数减小
C.平衡移动后,CO和CO2的浓度都没有改变
D.平衡移动后,CaO的质量减少
(2)某温度下数据:Kφ(CaC2O4)=5.0×10-9;Kφ(CaCO3)=2.5×10-9
向0.6mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:
CO32-(aq)+CaC2O4(s)?CaCO3(s)+C2O42-(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42-)=0.4mol•L-1.
Ⅱ.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0其他条件相同时,在相同时间内,反应分别在不同催化剂(Ⅰ、Ⅱ、Ⅲ)或不同温度下反应,测得CH4的转化率变化如图所示.

(1)在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
(2)a点v正(CH4)大于v逆(CO)(填写“大于”、“小于”或“等于”).
(3)c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
Ⅲ.工业上用焦炭与水蒸气在高温下制取水煤气,在化工生产中有重要用途.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:
C(s)+2H2O(g)?CO2(g)+2H2(g).其相关数据如表所示:
(1)温度T2>T1的理由是甲乙两容器中反应物浓度相同,乙达到平衡所有时间短,说明T2温度高.
(2)该反应达到平衡后,升高温度,H2O(g)的转化率变小(填写“变大”、“变小”).
Ⅰ:草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
(1)在一定温度下向1L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=0.04mol•L-1•min-1;当反应达到平衡后,将容器体积压缩为0.5L,一段时间后反应再次达到平衡,则下列说法正确的是CD(填答案选项编号).
A.压缩容器体积,CaC2O4的分解率增大
B.平衡移动后,该反应的化学平衡常数减小
C.平衡移动后,CO和CO2的浓度都没有改变
D.平衡移动后,CaO的质量减少
(2)某温度下数据:Kφ(CaC2O4)=5.0×10-9;Kφ(CaCO3)=2.5×10-9
向0.6mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:
CO32-(aq)+CaC2O4(s)?CaCO3(s)+C2O42-(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42-)=0.4mol•L-1.
Ⅱ.甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0其他条件相同时,在相同时间内,反应分别在不同催化剂(Ⅰ、Ⅱ、Ⅲ)或不同温度下反应,测得CH4的转化率变化如图所示.

(1)在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是Ⅰ>Ⅱ>Ⅲ.
(2)a点v正(CH4)大于v逆(CO)(填写“大于”、“小于”或“等于”).
(3)c点CH4的转化率高于b点,原因是b和c都没平衡,c点温度高,反应速率快,相同时间内转化率高.
Ⅲ.工业上用焦炭与水蒸气在高温下制取水煤气,在化工生产中有重要用途.一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生反应:
C(s)+2H2O(g)?CO2(g)+2H2(g).其相关数据如表所示:
| 容积 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O | H2 | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
(2)该反应达到平衡后,升高温度,H2O(g)的转化率变小(填写“变大”、“变小”).
15.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 3.0 L 0.1 mol•L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7: c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) | |
| C. | 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则原醋酸溶液醋酸的电离度为1% | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
12.随着科技发展,新型电池层出不穷.图1为肼(N2H4)燃料电池,图2为光伏并网发电装置.LED(半导体照明)是由GaN芯片和钇铝石榴石(YAG,化学:Y3Al5O12)芯片装在一起而做成,其在运动会场馆内也随处可见.下列有关说法中正确的是( )
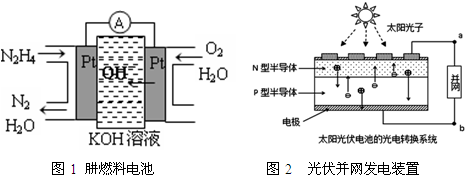

| A. | 氢氧燃料电池、太阳光伏电池中都利用了原电池原理 | |
| B. | 图1左边电极上发生的电极反应式为:N2H4-4e-+4OH-=N2+4H2O | |
| C. | 图2中N型半导体为正极,P型半导体为负极 | |
| D. | LED中的Ga和Y不可能都显+3价 |
19.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子材料 | |
| B. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| C. | 太阳能电池板中的硅是硅单质,光导纤维的主要成分是二氧化硅 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化、杀菌消毒 |
9.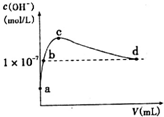 常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )
常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )
 常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )
常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
16.下列说法中正确的是( )
| A. | 为防止食品氧化变质,食品袋中放有硅胶包 | |
| B. | 酒精用来杀菌消毒,利用了乙醇的氧化性 | |
| C. | 植物油与矿物油可以通过水解反应区分 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
13.稀土元素号称“工业维生素”,科学家把稀土元素镧对作物的作用赋予“超级钙”的美称.已知镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3,La(OH)3是不溶于水的弱碱,而LaCl3、La(NO3)3都可溶于水,下列说法中正确的是( )
| A. | La(NO3)3水溶液显酸性 | |
| B. | LaCl3的水溶液加热蒸发灼烧,最终得到无水LaCl3 | |
| C. | La和盐酸反应的离子方程式为:La+2H+=La3++H2↑ | |
| D. | 镧有两种核素:57139La和放射性57138La,由此可知镧元素的相对原子质量为138.5 |
 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.