题目内容
3.氮及其化合物在工农业生产、生活中有着重要作用.图1是1molNO2和1mol CO反应生成NO和CO2过程中能量变化示意图.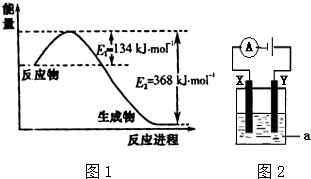
请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)═NO (g)+CO2(g)△H=-234kJ/mol.
分析 根据图象知,反应物能量大于生成物总能量,所以该反应是放热反应,该反应的△H=E1-E2=134kJ/mol-368kJ/mol=-234kJ/mol.
解答 解:根据图象知,反应物能量大于生成物总能量,所以该反应是放热反应,该反应的△H=E1-E2=134kJ/mol-368kJ/mol=-234KJ/mol,所以其热化学反应方程式为:NO2(g)+CO(g)═NO (g)+CO2(g)△H=-234kJ/mol,
故答案为:NO2(g)+CO(g)═NO (g)+CO2(g)△H=-234kJ/mol.
点评 本题考查热化学方程式的书写,观察图象,找出活化能的变化,从而求出反应热是解题的关键.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
13.稀土元素号称“工业维生素”,科学家把稀土元素镧对作物的作用赋予“超级钙”的美称.已知镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3,La(OH)3是不溶于水的弱碱,而LaCl3、La(NO3)3都可溶于水,下列说法中正确的是( )
| A. | La(NO3)3水溶液显酸性 | |
| B. | LaCl3的水溶液加热蒸发灼烧,最终得到无水LaCl3 | |
| C. | La和盐酸反应的离子方程式为:La+2H+=La3++H2↑ | |
| D. | 镧有两种核素:57139La和放射性57138La,由此可知镧元素的相对原子质量为138.5 |
11.下列说法不正确的是( )
| A. | KMnO4和SO2的反应速率可通过分光光度计用比色法测出不同反应时刻的浓度来计算. | |
| B. | 蒸馏时可用多种方法控制温度,用水浴加热分离碘并回收苯时,实验结束后,碘留在蒸馏烧瓶中. | |
| C. | 金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠保存在煤油中,白磷则可保存在水中. | |
| D. | 工业上电解饱和和盐水时,从安全性和综合效率角度考虑,往往用阴离子交换膜把阳极和阴极隔开 |
3.用NA代表阿伏伽德罗常数,下列说法正确的是( )
| A. | 14gC2H4和C4H8NA的混合气体中所含的共价键数为3NA | |
| B. | 化学反应中每生成1molO2转移电子数为4NA | |
| C. | 12g413C含有的碳原子数是NA | |
| D. | 0.1molNa2O2所含阴离子数是0.2NA |
7.组成为C4H10O的醇与乙二酸(HOOC-COOH)在一定条件下生成的二元酯的种类有( )
| A. | 4种 | B. | 8种 | C. | 10种 | D. | 16种 |
8.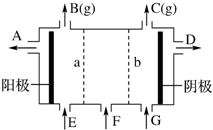 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
 现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽.用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液.下列说法中正确的是( )| A. | b是阳离子交换膜,允许Na+通过 | B. | 从A口出来的是NaOH溶液 | ||
| C. | 阴极反应式为4OH--4e-═2H2O+O2↑ | D. | Na2SO4溶液从G口加入 |
 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.