题目内容
15.如图是常温下部分短周期元素,最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,其中H的氧化物是两性氧化物.下列说法正确的是( )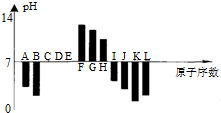
| A. | 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大. | |
| B. | 根据图形分析可知,K,L两种元素最高价氧化物对应的水化物的酸性,前者较强. | |
| C. | 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同. | |
| D. | 元素K、H、G分别形成的简单离子的半径逐渐减少 |
分析 均为短周期元素,F、G、H的最高价氧化物对应水化物呈碱性,A、B、I、J、K、L的最高价氧化物对应水化物呈酸性,其中H的氧化物是两性氧化物,则H为Al,由溶液pH及原子序数,可推知A为碳、B为氮、C为氧、D为氟、E为Ne、F为Na、G为Mg、I为Si、J为P、K为S、L为Cl,据此解答.
解答 解:均为短周期元素,F、G、H的最高价氧化物对应水化物呈碱性,A、B、I、J、K、L的最高价氧化物对应水化物呈酸性,其中H的氧化物是两性氧化物,则H为Al,由溶液pH及原子序数,可推知A为碳、B为氮、C为氧、D为氟、E为Ne、F为Na、G为Mg、I为Si、J为P、K为S、L为Cl.
A.由于NH3分子之间存在氢键,沸点高于PH3,与键能无关,故A错误;
B.常温下相同浓度时,硫酸溶液的pH较小(比较氢离子浓度),但高氯酸的酸性强于硫酸,从电离的难易程度比较,故B错误;
C.晶体SiO2属于原子晶体,熔化时克服共价键,晶体SCl2属于共价化合物,与水反应时克服共价键,故C正确;
D.电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Mg2+>Al3+,故D错误,
故选:C.
点评 本题考查位置结构性质关系综合应用,关键根据原子序数与相同浓度最高价氧化物对应水化物的酸碱性判断元素,B选项中注意溶液pH与电解质酸碱性强弱比较角度不同,难度中等.

练习册系列答案
相关题目
5.下列说法不正确的是( )
| A. | 生物质能的利用主要有以下几种方式:直接燃烧、生物化学转换和热化学转换 | |
| B. | 在人类研究物质微观结构的过程中,光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器先后得到了使用 | |
| C. | 能源可分为一次能源和二次能源,化学电源也可分为一次电池和二次电池 | |
| D. | 碰撞理论和过渡态理论是常用的反应速率理论,其中过渡态理论可解释温度、催化剂等对反应速率的影响 |
6.下列对原电池的分析不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| D. | 由Al、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
3.下列各组混合物,可以用分液漏斗分离的是( )
| A. | 四氯化碳和溴 | B. | 乙醇和水 | C. | 苯和汽油 | D. | 乙酸乙酯和水 |
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 | |
| B. | 采用加热方法消毒的目的是使蛋白质变性而杀灭细菌 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 |
20.六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E 同主族,B与F 同主族,E与F同周期.已知常温下单质A与E的状态不同,D的核电荷数是B的最外层电子数的2倍,单质F是一种重要的半导体材料.则下列推断中正确的是( )
| A. | A、C两种元素可组成化学式为C2A4的化合物 | |
| B. | E氧化物的水化物有两性 | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
7.已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.请回答下列问题:
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是:HF和H2O分子之间能形成氢键.
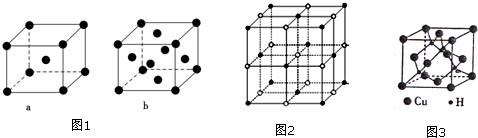
(2)比E少5个质子的原子基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图1中的a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似
(如图2所示),其中3种离子晶体的晶格能数据如表:
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:TiN>MgO>CaO>KCl.
(4)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
(5)铜是第四周期最重要的过度元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图3所示,若
CuH的密度为d g•cm-3,阿伏加德罗常数的数值为NA,则Cu+与H-的核间距为$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm(用含d和NA的代数式表示).
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是:HF和H2O分子之间能形成氢键.
(2)比E少5个质子的原子基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图1中的a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似
(如图2所示),其中3种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(4)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
(5)铜是第四周期最重要的过度元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图3所示,若
CuH的密度为d g•cm-3,阿伏加德罗常数的数值为NA,则Cu+与H-的核间距为$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm(用含d和NA的代数式表示).

5.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>H2S | B. | 原子半径:N>O | ||
| C. | 结合质子能力:S2->Cl- | D. | 酸性:H2SO3>H2SO4 |


 .
. .
.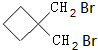 +CH2(COOC2H5)2+2C2H5ONa→
+CH2(COOC2H5)2+2C2H5ONa→ +2NaBr+2C2H5OH.
+2NaBr+2C2H5OH. .
.