题目内容
14.下列各离子组在溶液中能大量共存且通入括号中相应气体后,仍能大量共存的是( )| A. | NH4+、Ca2+、HSO3-、Cl- (氨气) | B. | Ba2+、NO3-、Na+、Cl- (二氧化硫) | ||
| C. | Na+、K+、HCO3-、Cl- (二氧化碳) | D. | Al3+、SO42-、HCO3-、NO3- (氯化氢) |
分析 A.亚硫酸氢根离子、钙离子与氨气反应生成亚硫酸钙沉淀;
B.二氧化硫溶于水显示酸性,硝酸根离子在酸性条件下能够将二氧化硫氧化成硫酸根离子,硫酸根离子与钡离子结合生成硫酸钡沉淀;
C.四种离子之间不反应,通入二氧化碳后也不反应;
D.铝离子与碳酸氢根离子发生双水解反应,通入HCl后碳酸氢根离子与氯化氢反应.
解答 解:A.Ca2+、HSO3-与氨气反应生成亚硫酸钙沉淀,故A错误;
B.通入二氧化硫后,溶液显示酸性,Ba2+、NO3-、SO2之间发生氧化还原反应生成硫酸钡沉淀,在溶液中不能大量共存,故B错误;
C.Na+、K+、HCO3-、Cl-之间不发生反应,通入二氧化碳后也不发生反应,在溶液中能够大量共存,故C正确;
D.Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,且通入HCl后,氯化氢与HCO3-发生反应,故D错误;
故选C.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,明确是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
相关题目
8.NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,1mol甲基(14C1H3-)所含的中子数和电子数分别为8NA、10NA | |
| B. | 标准状况下,11.2L五氯化磷中含有P-Cl键的数目为2.5NA | |
| C. | 标准状况下,2.24L Cl2全部被NaOH溶液吸收,转移的电子数目为0.2NA | |
| D. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2molN2转移的电子数目为6NA |
5.下列说法不正确的是( )
| A. | 生物质能的利用主要有以下几种方式:直接燃烧、生物化学转换和热化学转换 | |
| B. | 在人类研究物质微观结构的过程中,光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器先后得到了使用 | |
| C. | 能源可分为一次能源和二次能源,化学电源也可分为一次电池和二次电池 | |
| D. | 碰撞理论和过渡态理论是常用的反应速率理论,其中过渡态理论可解释温度、催化剂等对反应速率的影响 |
2.下列关于各图象的解释或得出结论正确的是( )
| A. | 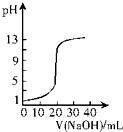 如图表示0.10 mol•L-1 NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 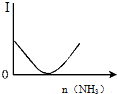 如图表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 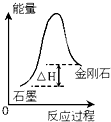 根据如图所示可知:石墨比金刚石稳定 | |
| D. | 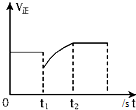 如图表示反应2SO2+O2?2SO3,t1时刻只减小了SO3的浓度 |
9.化学与资源、环境、生活关系密切,下列说法正确的是( )
| A. | 硅的性质较稳定,在自然界中存在游离态的硅 | |
| B. | 陶瓷、水泥、玻璃、金刚砂均为传统无机非金属材料 | |
| C. | 水泥、普通玻璃的制备均要用到石灰石 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱溶液无影响 |
6.下列对原电池的分析不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| D. | 由Al、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
3.下列各组混合物,可以用分液漏斗分离的是( )
| A. | 四氯化碳和溴 | B. | 乙醇和水 | C. | 苯和汽油 | D. | 乙酸乙酯和水 |


 .
. .
.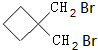 +CH2(COOC2H5)2+2C2H5ONa→
+CH2(COOC2H5)2+2C2H5ONa→ +2NaBr+2C2H5OH.
+2NaBr+2C2H5OH. .
.