题目内容
13.目前工业合成氨的原理是N2(g)+3H2?2NH3(g),△H=-93.O kJ•mol-1(1)已知一定条件下:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),△H=十l 530.O kJ•mol一1.则氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286.0 kJ/mol
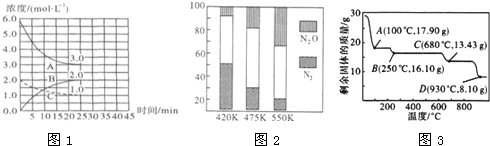
(2)如图,在恒温恒容装置中进行合成氨反应.
①表示N2浓度变化的曲线是C.
②前25min内,用H2浓度变化表示的化学反应速率是0.12 mol•L-1•min-1.
③在25min末刚好平衡,则平衡常数K=$\frac{4}{27}$.
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是AD.
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后.压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g)?5N2(g)+6H2O(g),△H<0,副反应②:2NH3(g)+8NO(g)?5N20(g)4-3H2O(g)△H>0.平衡混合气中N2与N20含量与温度的关系如图2.
请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是随温度升高,N2的含量降低,导致这种规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移(任答合理的一条原因).
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3(g)+302=2N2+6H2O.则负极电极反应式为2NH3+6OH--6e-=N2+6H2O.
(6)取28.70g ZnSO4•7H20加热至不同温度,剩余固体的质量变化如图3所示.680℃时所得固体的化学式为b(填字母序号).a.ZnO b.Zn30(S04)2 c.ZnS04 d.ZnS04•H 20
分析 (1)已知①2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.
②N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol,利用盖斯定律将$\frac{②×2-①}{6}$可得氢气燃烧的热化学方程式;
(2)①根据图象中氮气的浓度的减少是氢气减少的$\frac{1}{3}$,C为氮气的浓度变化曲线;
②根据图象中的浓度变化及时间计算出用N2的浓度变化表示的化学反应平均速率;
③根据平衡常数K=$\frac{c(NH{\;}_{3}){\;}^{2}}{c(N{\;}_{2})•c(H{\;}_{2}){\;}^{3}}$表达式计算出该反应的平衡常数;
(3)根据化学平衡状态特征进行判断;
(4)根据图2中随着温度升高,氮气、N2O的含量变化进行分析;根据温度对化学平衡影响及两个可逆反应的反应热情况进行分析;
(5)根据原电池原电池工作原理及电极反应写出该燃料电池的负极反应式;
(6)28.70 g ZnSO4•7H2O的物质的量为0.1mol,分别分析生成ZnO、ZnSO4、ZnSO4•H2O的质量,进而确定温度.
解答 解:(1)已知①2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol.
②N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol,利用盖斯定律将$\frac{②×2-①}{6}$可得H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286.0 kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286.0 kJ/mol;
(2)①图象中氮气的浓度的减少是氢气减少的$\frac{1}{3}$,C为氮气的浓度变化曲线,故答案为:C;
②图象中氮气的浓度的减少是氢气减少的$\frac{1}{3}$,A为氢气的浓度变化曲线,v(H2)=$\frac{6.0-3.0}{25}$mol•L-1•min-1=0.12mol•L-1•min-1,故答案为:0.12 mol•L-1•min-1;
③在25 min 末反应刚好达到平衡,K=$\frac{c(NH{\;}_{3}){\;}^{2}}{c(N{\;}_{2})•c(H{\;}_{2}){\;}^{3}}$=$\frac{4}{1×3{\;}^{3}}$=$\frac{4}{27}$;故答案为:$\frac{4}{27}$;
(3)A.合成氨反应前后气体体积不同,当体积不变时,得到化学平衡状态,故A正确;
B.$ρ=\frac{m}{V}$,气体质量不变,由于反应前后气体体积不同,恒压容器气体体积可变,化学平衡移动时,密度随之变化,当密度不变时,达到化学平衡状态,故B错误;
C.充入Ar,容器压强不变,则:N2、H2、和NH3浓度降低,反应物浓度降低大,化学平衡向逆反应方向移动,故C错误;
D.平衡时,压缩体积,压强增大,化学平衡向正反应方向移动,NH3浓度增大,故D正确;
故选:AD;
(4)根据图象可知,在400K~600K时,平衡混合气中N2含量随温度的升高逐渐降低;主反应为放热反应,升高温度,平衡向着逆向移动,氮气的含量减小,
故答案为:随温度升高,N2的含量降低;主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移;
(5)原电池负极失去电子发生氧化反应,所以该燃料电池中负极氨气失去电子生成氮气,电极反应式为2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O;
(6)28.70 g ZnSO4•7H2O的物质的量为0.1mol,若得ZnSO4•H2O的质量为17.90g,则温度为100℃;若得ZnSO4的质量为16.10g,则温度为250℃;若得ZnO的质量为8.10g,则温度为930℃;据此通过排除法确定680℃时所得固体的化学式为Zn3O(SO4)2;
故答案为:b.
点评 本题考查较综合,涉及知识点较多,涉及通过图象分析化学反应速率、化学平衡及计算等问题,为高频考点,侧重于学生的分析能力和计算能力的考查,需要学生较强的观察能力及思维能力,难度较大;

| A. | 用石灰乳吸收氯气:2Cl2+2OH-=2Cl-+2ClO-+H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=4OH-+2I2 | |
| C. | 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+13H+=4Cr3++11H2O+3CH3COO- | |
| D. | 碳酸氢铵与足量的氢氧化钙溶液反应:HCO3-+NH4++2OH-=NH3•H2O+H2O+CO32- |
| A. | 常温常压下,1mol甲基(14C1H3-)所含的中子数和电子数分别为8NA、10NA | |
| B. | 标准状况下,11.2L五氯化磷中含有P-Cl键的数目为2.5NA | |
| C. | 标准状况下,2.24L Cl2全部被NaOH溶液吸收,转移的电子数目为0.2NA | |
| D. | 已知反应:2NH3+NO+NO2═2N2+3H2O,每生成2molN2转移的电子数目为6NA |
| A. | 在沸腾炉和接触室中,均使用过量的高压空气,以提高硫铁矿的燃烧利用率和二氧化硫的催化氧化转化率 | |
| B. | 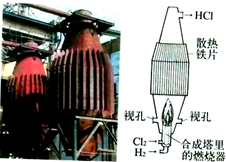 如图是工业制盐酸的设备及其简易图 | |
| C. | 氯碱工业是中国现代化工之母,其主要反应是电解海水,得到烧碱和氯气,因此称为氯碱工业 | |
| D. | 合成氨工业是工业制硝酸和工业制纯碱的前提和保证,前者可为后两者共提供了不止一种原料 |
芥酸 雌性信息素
则下列说法不正确的是( )
| A. | X只有1种结构 | |
| B. | 雌性信息素可能是烯烃,会使溴水褪色 | |
| C. | 电解的阳极反应式为:C21H41COOH+X+2H2O-2e-→C23H46+2CO32-+6H+ | |
| D. | 阴极的还原产物为H2 |
| A. | 生物质能的利用主要有以下几种方式:直接燃烧、生物化学转换和热化学转换 | |
| B. | 在人类研究物质微观结构的过程中,光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器先后得到了使用 | |
| C. | 能源可分为一次能源和二次能源,化学电源也可分为一次电池和二次电池 | |
| D. | 碰撞理论和过渡态理论是常用的反应速率理论,其中过渡态理论可解释温度、催化剂等对反应速率的影响 |
| A. | 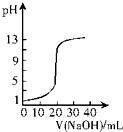 如图表示0.10 mol•L-1 NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. |  如图表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 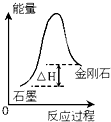 根据如图所示可知:石墨比金刚石稳定 | |
| D. | 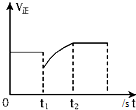 如图表示反应2SO2+O2?2SO3,t1时刻只减小了SO3的浓度 |
| A. | 四氯化碳和溴 | B. | 乙醇和水 | C. | 苯和汽油 | D. | 乙酸乙酯和水 |
