题目内容
18.实验室常用于保存钠的液体是( )| A. | 煤油 | B. | 水. | C. | 汽油 | D. | 四氯化碳 |
分析 化学试剂的存放与化学试剂的物理性质和化学性质有关,易挥发的物质要密封保存,见光易分解的物质要避光保存,易与氧气、水、二氧化碳反应的物质要隔绝空气保存,以此解答该题.
解答 解:钠与煤油不反应,密度比煤油大,可保存在煤油中,故A正确;
B、钠能与水反应生成氢气和氢氧化钠,故B错误;
C、汽油易挥发、易燃烧,所以不能将钠保存在汽油里,一般保存在煤油中,故C错误;
D、四氯化碳的密度大于钠,钠浮在其表面上,不能起到隔绝空气和水的作用,故D错误,故选A.
点评 本题考查试剂的存放,明确物质的性质(钠的性质)与保存方法的关系是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
8.家蝇的雌性信息素可用芥酸(来自菜籽油)与羧酸X在浓NaOH溶液中进行阳极氧化得到.电解总反应式为:C21H41COOH+X+4NaOH→C23H46+2Na2CO3+2H2O+H2↑
芥酸 雌性信息素
则下列说法不正确的是( )
芥酸 雌性信息素
则下列说法不正确的是( )
| A. | X只有1种结构 | |
| B. | 雌性信息素可能是烯烃,会使溴水褪色 | |
| C. | 电解的阳极反应式为:C21H41COOH+X+2H2O-2e-→C23H46+2CO32-+6H+ | |
| D. | 阴极的还原产物为H2 |
9.化学与资源、环境、生活关系密切,下列说法正确的是( )
| A. | 硅的性质较稳定,在自然界中存在游离态的硅 | |
| B. | 陶瓷、水泥、玻璃、金刚砂均为传统无机非金属材料 | |
| C. | 水泥、普通玻璃的制备均要用到石灰石 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱溶液无影响 |
6.下列对原电池的分析不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| D. | 由Al、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
3.下列各组混合物,可以用分液漏斗分离的是( )
| A. | 四氯化碳和溴 | B. | 乙醇和水 | C. | 苯和汽油 | D. | 乙酸乙酯和水 |
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 | |
| B. | 采用加热方法消毒的目的是使蛋白质变性而杀灭细菌 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 |
7.已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.请回答下列问题:
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是:HF和H2O分子之间能形成氢键.
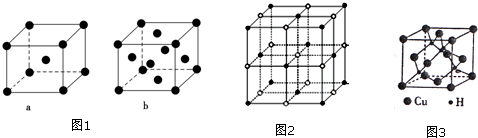
(2)比E少5个质子的原子基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图1中的a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似
(如图2所示),其中3种离子晶体的晶格能数据如表:
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:TiN>MgO>CaO>KCl.
(4)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
(5)铜是第四周期最重要的过度元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图3所示,若
CuH的密度为d g•cm-3,阿伏加德罗常数的数值为NA,则Cu+与H-的核间距为$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm(用含d和NA的代数式表示).
(1)元素A简单氢化物中A原子的杂化类型是sp3,B、C、D的电负性由小到大的顺序为Na<Cl<F(用所对应的元素符号表示).C的气态氢化物易溶于水的原因是:HF和H2O分子之间能形成氢键.
(2)比E少5个质子的原子基态电子排布式为1s22s22p63s23p63d54s1或〔Ar〕3d54s1.元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图1中的a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为2:1.
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似
(如图2所示),其中3种离子晶体的晶格能数据如表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
(4)温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有6mol σ键和2mol π键断裂.
(5)铜是第四周期最重要的过度元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图3所示,若
CuH的密度为d g•cm-3,阿伏加德罗常数的数值为NA,则Cu+与H-的核间距为$\frac{\sqrt{3}}{4}×$$\root{3}{\frac{65×4}{d{N}_{A}}}$cm(用含d和NA的代数式表示).

8.下列叙述中错误的是( )
| A. | 用水可以鉴别乙醇、苯、和溴苯 | |
| B. | 甲苯与氯气在光照下可发生取代反应,主要生成2,4-二氯甲苯 | |
| C. | 化学式为C7H16的有机物,分子中含有3个甲基的可能结构有3种 | |
| D. | 乙酸丁酯中含乙酸杂质,可以加入饱和碳酸钠溶液洗涤,然后通过分液来去除杂质 |
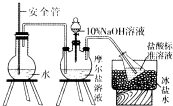 硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.
硫酸亚铁铵俗名摩尔盐.化学式为x(NH4)2SO4•yFeSO4•zH2O,可用来净水或治疗缺铁性贫血等.某实验小组利用下面的方法来测定其组成.