题目内容
11.氮氧化物进入大气后,会形成硝酸型酸雨、光化学烟雾等污染.因此必须对含有氮氧化物的废气进行处理.(1)用氢氧化钠溶液可以吸收废气中的氮氧化物NO2和NO,反应的化学方程式如下:
NO2+NO+2NaOH═2NaNO2+H2O 在该反应中,氧化剂是NO2,氧化产物是NaNO2.
(2)根据氮元素化合价,预测NaNO2具有的性质:既有氧化性又有还原性.
(3)若反应中转移了0.3mol电子,则参加反应的气体在标准状况下体积为13.44L.
(4)汽车尾气中含有一氧化氮和一氧化碳,经过排气管中的催化转化器转化为对大气无污染的物质.写出该反应的化学方程式:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(5)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质.写出氨气和二氧化氮在一定条件下反应的化学方程式:6NO2+8NH3$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O.
分析 (1)所含元素化合价降低的反应物为氧化剂,所含元素化合价升降的反应物为还原剂,据此结合元素化合价判断;
(2)NaNO2中的氮是+3,既可以升高也可以降低,所以既有氧化性又有还原性;
(3)根据氧化还原反应中转移的电子数和产生氧气的量之间的关系解答;
(4)一氧化氮和一氧化碳经过排气管中的催化转化器转化为对大气无污染的物质,应生成氮气、二氧化碳;
(5)氨气和二氧化氮反应生成无污染的物质,则生成氮气与水.
解答 解:(1)反应NO2+NO+2NaOH═2NaNO2+H2O中,NO2中N元素化合价由+4价降低为NaNO2中的+3价,NO2是氧化剂;NO中N元素化合价由+2价上升为NaNO2中的+3价,NO是还原剂,氧化产物是NaNO2,故答案为:NO2;NaNO2;
(2)NaNO2中的氮是+3,既可以升高也可以降低,所以既有氧化性又有还原性,故答案为:既有氧化性又有还原性;
(3)NO2+NO+2NaOH═2NaNO2+H2O,电子的转移数目为1e-,反应转移了1mol电子消耗2mol的气体,如反应转移了0.3mol电子,则会消耗0.6mol即消耗13.44L的气体,故答案为:13.44L;
(4)一氧化氮和一氧化碳经过排气管中的催化转化器转化为对大气无污染的物质,应生成氮气、二氧化碳,反应方程式为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(5)氨气和二氧化氮反应生成无污染的物质,则生成氮气与水,反应方程式为:6NO2+8NH3$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O,
故答案为:6NO2+8NH3$\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O.
点评 本题以氮氧化物的废气处理为载体,考查氧化还原反应基本概念、化学方程式的书写等,难度不大,是对学生能力的考查,注意氧化还原反应的配平.

 阅读快车系列答案
阅读快车系列答案 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )| A. | a为正极是金属铜,b为负极是金属锌 | |
| B. | a极上H+得到电子,发生氧化反应 | |
| C. | b极金属发生反应(或称被腐蚀),发生氧化反应 | |
| D. | 该装置将化学能转变为电能 |
| A. | 乙醇与浓氢溴酸反应CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热CH3CH2Br+NaOH$→_{△}^{水}$ CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入少量的二氧化碳2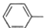 ONa+CO2+H2O→2 ONa+CO2+H2O→2 OH+Na2CO3 OH+Na2CO3 | |
| D. | 乙醛催化氧化 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH |
| A. | 氯化钠的电子式: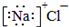 | B. | 氯化氢的电子式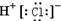 | ||
| C. | 碳元素位于周期表中第2周期ⅥA族 | D. | H2O的结构式:H-O-H |
| A. | 糖类、油脂、蛋白质均为高分子化合物 | |
| B. | 苯、邻二甲苯互为同系物 | |
| C. | 棉、麻、羊毛及合成纤维统称为化学纤维 | |
| D. | 合成聚乙烯与合成酚醛树脂的反应类型相同 |
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol. CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol. C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol. 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=$\frac{{{{(cα)}^2}}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,Ka变小 |
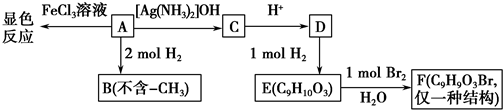
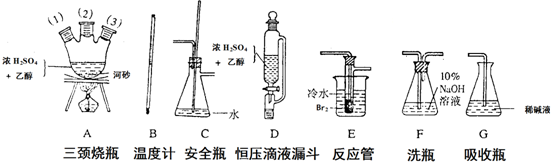
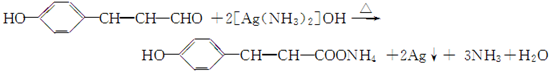 .
. .
. ,G的结构简式为:
,G的结构简式为: .
. .
. 或
或 (写出一个反应方程式即可).
(写出一个反应方程式即可).