题目内容
7.铅丹(Pb3O4)可作为防锈用涂料,呈红褐色.(1)铅丹可用PbO在空气中加热制备,请写出有关反应的化学方程式12PbO+2O2$\frac{\underline{\;\;△\;\;}}{\;}$4Pb3O4;
(2)铅丹曾用于铁制品防锈,请举例说明铁制品防锈的其他两种方法刷油漆、涂油等;
(3)铅丹与浓盐酸发硬生成PbCl2,Cl2和H2O,请写出反应的化学方程式,说明如何检验反应有氯气生成?
分析 (1)PbO在空气中加热生成Pb3O4,根据反应物、生成物及反应条件书写方程式;
(2)根据铁锈蚀的条件:铁与水、氧气充分接触时容易生锈,使铁制品与氧气和水隔绝可以防止生锈;据此进行分析解答;
(3)Pb3O4中+4价的Pb具有强氧化性,能氧化浓盐酸,+4价的Pb被浓盐酸还原成+2价,确定生成物PbC12、C12、H2O,再配平可得化学方程式;氯气具有强氧化性,能和碘离子反应生成碘单质,碘遇淀粉试液变蓝色,据此分析解答.
解答 解:(1)PbO在空气中加热生成Pb3O4,反应方程式为12PbO+2O2$\frac{\underline{\;\;△\;\;}}{\;}$4Pb3O4,
故答案为:12PbO+2O2$\frac{\underline{\;\;△\;\;}}{\;}$4Pb3O4;
(2)铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果,为了防止钢铁制品的锈蚀,人们常采用在其表面刷油漆、涂油或镀上其他金属等覆盖保护膜的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水,
故答案为:刷油漆、涂油等;
(3)Pb3O4中Pb有一个+4价、有两个+2价,且+4价的Pb具有强氧化性,能氧化浓盐酸生成C12,本身被还原成+2价Pb,生成PbC12,
根据元素守恒得反应物与生成物:Pb3O4+HCl(浓)→PbCl2+Cl2↑+H2O,根据化合价升降法配平该氧化还原反应,
Pb3O4中一个+4价的Pb降低到+2价,降低2价;HCl(浓)中-1价的Cl上升到0价生成Cl2,上升1价×2,所以Pb3O4和Cl2前面的计量数都为1,根据原子守恒配平其它物质前计量数,得各物质前计量数为1、8、3、1、4,故方程式为Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O,
氯气具有强氧化性,能和碘离子发生氧化还原反应生成碘单质,Cl2+2I-=I2+2Cl-,碘遇淀粉试液变蓝色,所以可用湿润的淀粉碘化钾试纸检验氯气,
答:Pb3O4+8HCl(浓)═3PbCl2+Cl2↑+4H2O;湿润的淀粉碘化钾试纸.
点评 本题考查氧化还原反应知识,利用题干信息确定反应物、产物,根据化合价升降法配平,抓住本质电子的得失守恒是解题的关键,题目难度中等.

| A. | 燃烧反应的发生一定要用火去引燃 | |
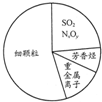
| B. | 右图为雾霾的主要成分示意图,其中SO2和NxOy都属于酸性氧化物,重金属离子可导致蛋白质变性 | |
| C. | 塑料、合成橡胶和合成纤维是我们熟悉的三大合成材料,它们都是以石油、煤和天然气为原料生产的 | |
| D. | 化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| B. | 四氯化碳的比例模型  | |
| C. | 氧原子的电子排布图  | |
| D. | ${\;}_{8}^{16}$O2-离子的结构示意图: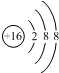 |
 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池,电子移动方向如图中所标.下列叙述错误的是( )| A. | a为正极是金属铜,b为负极是金属锌 | |
| B. | a极上H+得到电子,发生氧化反应 | |
| C. | b极金属发生反应(或称被腐蚀),发生氧化反应 | |
| D. | 该装置将化学能转变为电能 |
| A. | 乙醇与浓氢溴酸反应CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热CH3CH2Br+NaOH$→_{△}^{水}$ CH3CH2OH+NaBr | |
| C. | 苯酚钠中通入少量的二氧化碳2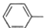 ONa+CO2+H2O→2 ONa+CO2+H2O→2 OH+Na2CO3 OH+Na2CO3 | |
| D. | 乙醛催化氧化 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH |
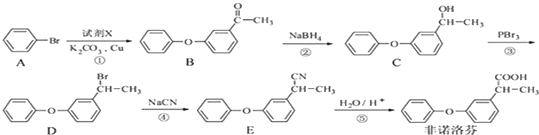
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaBr+H2O.
+NaBr+H2O. .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.

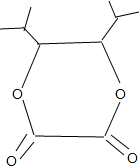 +2H2O;
+2H2O; ;
;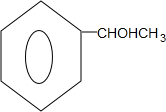 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.