题目内容
【题目】草酸(H2C2O4)是最简单的有机二元酸,具有较强的还原性,工业上主要用于生产药物以及提炼稀有金属。
工业上可由以下反应制取草酸(两步反应均为液相反应):
①4CO+4C4H9OH+O2![]() 2(COOC4H9)2+2H2O
2(COOC4H9)2+2H2O
②(COOC4H9)2+2H2O![]() H2C2O4+2C4H9OH-Q(Q>0)
H2C2O4+2C4H9OH-Q(Q>0)
(1)反应①选择13~15MPa的高压条件下进行,最主要的原因是为了___。若5min内水的质量增加了7.2g/L,则用水表示的反应速率为____。
(2)对于反应②,下列能够说明其已经达到平衡的是____。
a.平衡常数K保持不变 b.反应液的pH保持不变
c.丁醇的浓度保持不变 d.反应液的总质量保持不变
下列措施既能加快该反应速率,又有利于提高产率的是___。
a.合理升高反应温度 b.合理增大反应压强
c.增大水的用量 d.加入稀硫酸作为催化剂
(3)将物质的量浓度相同的草酸溶液与次氯酸钠溶液等体积混合,产生大量无色无味的气体,写出反应的化学方程式____。
(4)已知草酸氢钠溶液显酸性,下列措施能使草酸氢钠溶液中![]() 减小的是___。
减小的是___。
a.通入HCl气体 b.加入草酸晶体 c.通入NH3 d.加入草酸钾晶体
(5)已知:物质的量浓度相同的草酸溶液与亚硫酸钠溶液等体积混合,反应的化学方程式为:①H2C2O4+Na2SO3→NaHC2O4+NaHSO3;草酸溶液与过量的亚硫酸钠溶液混合,反应的化学方程式为:②H2C2O4+2Na2SO3→Na2C2O4+2NaHSO3;过量的草酸溶液与亚硫酸钠溶液混合,反应的化学方程式为:③2H2C2O4+Na2SO3→2NaHC2O4+H2O+SO2↑
根据以上信息判断草酸的两级电离常数(记为K1、K2)与亚硫酸的两级电离常数(记为K3、K4)由大到小的顺序____。
【答案】增大气体在丁醇中的溶解度,以有利于反应进行(或加快反应速率) 0.08mol/(Lmin) bc a NaClO+H2C2O4→NaCl+H2O+2CO2↑ bd K1>K3>K2>K4
【解析】
(1)根据反应①4CO+4C4H9OH+O2![]() 2(COOC4H9)2+2H2O可知,增大压强,有利于增大气体在丁醇中的溶解度,加快化学反应速率;若5min内水的质量增加了7.2g/L,则浓度增加0.4mol/L,则用水表示的反应速率为V(H2O)=
2(COOC4H9)2+2H2O可知,增大压强,有利于增大气体在丁醇中的溶解度,加快化学反应速率;若5min内水的质量增加了7.2g/L,则浓度增加0.4mol/L,则用水表示的反应速率为V(H2O)=![]() =0.08mol/(Lmin);
=0.08mol/(Lmin);
(2)反应(COOC4H9)2+2H2OH2C2O4+2C4H9OH-Q(Q>0)中;
a.温度不变,平衡常数不变,但不一定平衡,故a错误;
b.反应液中有乙二酸,溶液显酸性,反应液的pH保持不变,说明溶液中的乙二酸的浓度不变,则一定平衡,故b正确;
c.丁醇的浓度为变量,丁醇的浓度保持不变,则一定平衡,故c正确;
d.所有反应物和生成物均为液体,根据质量守恒,反应液的总质量总是保持不变,则不一定平衡,故d错误;
下列措施中,
a.合理升高反应温度,反应速率加快,平衡正向移动,故a正确;
b.增大反应压强,由于反应物和生成物均为液体,速率几乎无影响,平衡不移动,故b错误;
c.增大水的用量,水为纯液体,无影响,故c错误;
d.加入稀硫酸作为催化剂,化学反应速率加快,但平衡不移动,故d错误;
答案:bc;a;
(3)根据条件知,草酸具有还原性,次氯酸钠具有强氧化性,发生氧化还原反应,得到CO2气体,反应方程式为:NaClO+H2C2O4→NaCl+H2O+2CO2↑,故答案为:NaClO+H2C2O4→NaCl+H2O+2CO2↑;
(4)a.HCl气体,会与草酸氢根离子反应生成草酸,草酸氢根浓度降低,![]() 增大,故a误;
增大,故a误;
b.加入草酸晶体,使草酸氢根离子浓度增大,故![]() 减小,故b确;
减小,故b确;
c.通入NH3,促进草酸氢根电离,![]() 增大,故错误;
增大,故错误;
d.加入草酸钾晶体,抑制了草酸氢根离子的电离,使草酸根离子浓度增大,![]() 减小,故正确;
减小,故正确;
答案:bd;
(5)根据反应方程式可知,酸性强弱顺序为:H2C2O4>H2SO3>HC2O4->HSO3-,酸性越强,K越大,故K1>K3>K2>K4;
答案:K1>K3>K2>K4。

【题目】某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯(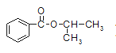 )。
)。
已知有关物质的沸点如下表:
物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 82.4 | 249 | 218 |
Ⅰ.合成苯甲酸异丙酯粗产品:
在如图的三颈烧瓶加入12.2g苯甲酸和30mL异丙醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,加入几块碎瓷片,维持温度85-90℃,加热30分钟,使反应充分,得苯甲酸异丙酯粗产品。
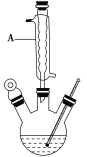
(1)仪器A的名称是_______,加入碎瓷片的作用是_______。
(2)制备苯甲酸异丙酯的化学方程式是______。
(3)合成过程中最适合的加热方式是____。
A.酒精灯直接加热 B.油浴
C.水浴 D.砂浴
Ⅱ.粗产品的精制:
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要玻璃仪器是_______;操作②的名称是_____。
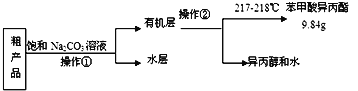
(5)结合上述相关数据进行计算,苯甲酸异丙酯的产率为______%。