题目内容
【题目】某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯(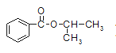 )。
)。
已知有关物质的沸点如下表:
物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 82.4 | 249 | 218 |
Ⅰ.合成苯甲酸异丙酯粗产品:
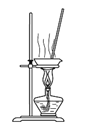
在如图的三颈烧瓶加入12.2g苯甲酸和30mL异丙醇(密度约为0.79g/cm3),再小心加入3mL浓硫酸,混匀后,加入几块碎瓷片,维持温度85-90℃,加热30分钟,使反应充分,得苯甲酸异丙酯粗产品。
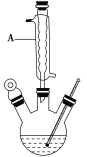
(1)仪器A的名称是_______,加入碎瓷片的作用是_______。
(2)制备苯甲酸异丙酯的化学方程式是______。
(3)合成过程中最适合的加热方式是____。
A.酒精灯直接加热 B.油浴
C.水浴 D.砂浴
Ⅱ.粗产品的精制:
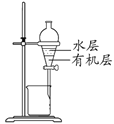
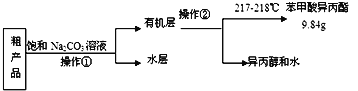
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,现拟用下列流程图进行精制,操作①中用到的一种重要玻璃仪器是_______;操作②的名称是_____。
(5)结合上述相关数据进行计算,苯甲酸异丙酯的产率为______%。
【答案】球形冷凝管 防止暴沸 ![]() +HO—CH(CH3)2
+HO—CH(CH3)2![]()
![]() +H2O C 分液漏斗 蒸馏 60
+H2O C 分液漏斗 蒸馏 60
【解析】
(1)根据仪器的结构可知,仪器A的名称是球形冷凝管,加入碎瓷片的作用是防止暴沸;
(2)苯甲酸与2-丙醇发生酯化反应制备苯甲酸异丙酯的化学方程式是 ![]() +HO—CH(CH3)2
+HO—CH(CH3)2![]()
![]() +H2O;
+H2O;
(3)因为要控制温度范围85-90℃,所以最好用水浴加热,选C;
(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等物质,苯甲酸异丙酯是不溶于水的液体,异丙醇、水能溶于饱和碳酸钠溶液,苯甲酸和碳酸钠发生反应,进入溶液,所以操作Ⅰ是分离互不相溶的液体混合物的方法,采用分液法分离,分液使用的主要玻璃仪器为分液漏斗;根据互溶的液体混合物中物质沸点的不同,采用蒸馏的方法分离;
(5)12.2 g苯甲酸和30 mL异丙醇(密度约为0.79 g·cm-3),根据所给数据计算,异丙醇质量是23.7g,12.2g苯甲酸需要6.0g异丙醇,所以异丙醇过量,所以理论上制得的产品的质量是![]() =16.4g,则产品的产率为
=16.4g,则产品的产率为![]() ×100%=60%。
×100%=60%。