题目内容
【题目】A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。D与A同周期,其最高正价与最低负价代数和为零。A、E可形成AE3型分子,分子中只存在极性键。
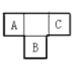
(1)B元素在元素周期表中的位置是____________________。
(2)C的离子结构示意图为__________________,用电子式表示AE3的形成过程:_______________________________________。
(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有____________。
(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可)_________________在铜锌硫酸原电池中,若负极减少是13g,则正极产生__________升气体(标准状况)?
【答案】第三周期第ⅥA族 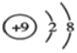
![]() 离子键、极性共价键 2HNO3+Na2CO3=2NaNO3+H2O+CO2↑ 4.48L
离子键、极性共价键 2HNO3+Na2CO3=2NaNO3+H2O+CO2↑ 4.48L
【解析】
设A的质子数为x,则B的质子数为x+9,C的质子数为x+2,则有x+x+2=x+9,x=7,则A为N元素,B为S元素,C为F元素,D与A同周期,其最高正价与最低负价代数和为零,则D为C元素,A、E可形成AE3型分子,分子中只存在极性键,应为NH3,则E为H元素,根据元素原子结构的特点结合元素周期律分析解答。
(1)B为S元素,原子序数为16,原子核外有3个电子层,最外层电子数为6,则应位于第三周期ⅥA族,故答案为第三周期ⅥA族;
(2)C为F元素,原子核内有9个质子,对应的离子核外有8个电子,2个电子层,则离子的结构示意图为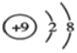 ;NH3为共价化合物,用电子式表示的形成过程为
;NH3为共价化合物,用电子式表示的形成过程为![]() ,故答案为
,故答案为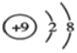 ;
;![]() ;
;
(3)由元素A、C及氢元素形成的化合物为NH4F,为离子化合物,含有离子键和极性共价键,故答案为离子键、极性共价键;
(4)A为N元素,D为C元素,N的非金属性较C强,所对应的最高价氧化物的水化物的酸性也强,将硝酸加入到碳酸钠溶液中可发生反应:2HNO3+Na2CO3=2NaNO3+H2O+CO2↑,可用来证明C与N的非金属性强弱;在铜锌硫酸原电池中,Zn的活泼性比Cu强,故Zn为负极,负极反应式为Zn-2e-=Zn2+,溶液中H+得电子为正极,正极反应式为2H++2e-=H2↑,负极减少13g,在电池反应中转移![]() =0.4mol电子,故正极生成氢气:
=0.4mol电子,故正极生成氢气:![]() =4.48L,故答案为2HNO3+Na2CO3=2NaNO3+H2O+CO2↑;4.48L。
=4.48L,故答案为2HNO3+Na2CO3=2NaNO3+H2O+CO2↑;4.48L。