��Ŀ����
����Ŀ��һ���¶��������Ϊ5L���ܱ������з���ij���淴Ӧ���仯ѧƽ�ⳣ������ʽΪ��K=![]() ��
��
��1����д���÷�Ӧ�Ļ�ѧ����ʽ��___��
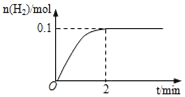
��2�����º��������������������ƽ����Է�������������ķ����������������___������ʱ��仯������˵���÷�Ӧ�Ѵ�ƽ��״̬��
��3���÷�Ӧ���淴Ӧ������ʱ��仯�Ĺ�ϵ��ͼ��t1ʱ��ͻ��һ������Ϊij�������ĸı䣬�øı䲻������___��
a����СH2Ũ�� b��ʹ�ô��� c�������¶�
���𰸡�C(s)+H2O(g)CO(g)+H2(g) ѹǿ���ܶ� ab
��������
��1�����ݻ�ѧƽ�ⳣ������ʽ֪����������CO����������Ӧ����ˮ������Ԫ���غ�֪����Ӧ�ﻹ����C��
��2�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
��3���ı�����ʱ�淴Ӧ�����������ŷ�Ӧ�Ľ��У��淴Ӧ����������˵��ƽ�������ƶ����ݴ˽��
��1�����ݻ�ѧƽ�ⳣ������ʽ֪����������CO����������Ӧ����ˮ������Ԫ���غ�֪����Ӧ�ﻹ����C�����Ըÿ��淴ӦΪC(s)+H2O(g)CO(g)+H2(g)��
�ʴ�Ϊ��C(s)+H2O(g)CO(g)+H2(g)��
��2���÷�Ӧǰ�����������֮���������Ժ��º��������������������ƽ����Է�������������ķ����������������ѹǿ���ܶȶ��ı䣬����Щ��������ʱ��仯ʱ�÷�Ӧ�ﵽƽ��״̬��
�ʴ�Ϊ��ѹǿ���ܶȣ�
��3���ı�����ʱ�淴Ӧ����ͻȻ�������ŷ�Ӧ�Ľ��У��淴Ӧ���ʼ�������˵��ƽ�������ƶ���
a����СH2Ũ�ȣ��淴Ӧ���ʼ�С���˸ı䲻���ܣ�a����ȷ��
b��ʹ�ô������淴Ӧ����������ƽ�ⲻ�ƶ����˸ı䲻���ܣ�b����ȷ��
c��̼��ˮ�����ķ�Ӧ�������ȷ�Ӧ�������¶ȣ������ƶ������淴Ӧ���ʶ����˸ı���ܣ�c�����
�ʴ�Ϊ��ab��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij�ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɼ���(CH3OCH3)�����ȼ�ϡ�����Ȼ����øúϳ��������п��ܷ����ķ�Ӧ�У�
��CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H1��+206.1 kJ��mol-1
CO(g)+3H2(g) ��H1��+206.1 kJ��mol-1
��CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H2��+247.3 kJ��mol-1
2CO(g)+2H2(g) ��H2��+247.3 kJ��mol-1
��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H3
CO2(g)+H2(g) ��H3
��ش��������⣺
��1����һ�ܱ������н��з�Ӧ�������CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ��ʾ������10 minʱ���ı���������������__________________________��

��2����Ӧ������H3��_____________��800 ��ʱ����Ӧ����ƽ�ⳣ��K��1����ø��¶����ܱ�������ijʱ�̸����ʵ����ʵ������±���
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ��_________(�����)��
a��v��>v�� b��v��<�� c��v����v�� d�����ж�
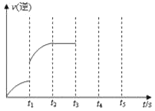
��3����ͼ2��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·�����Ӧ������ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������CH4��ת������ʱ��ı仯��ͼ3��ʾ������ͼ3�л�����������CH4��ת������ʱ��仯��ͼ��___________

��4��ij�ϳ�������Ҫ�ɷ��е�һ����̼����һ��������Ҳ����NaOH��Һ��CO��Ӧ���ɼ�����(HCOONa)����һ����Ӧ���ɼ���������CO��Ⱦ�������½�a mol��COͨ��2 L b mol��L-1NaOH��Һ�У�ǡ����ȫ��Ӧ���ɼ����ƺͺ���������Ļ����Һ(������Һ�������)�������Һ��c(Na+)=c(HCOO-)����û����Һ�м���ĵ���ƽ�ⳣ��Ka=_________(�ú�a��b�Ĵ���ʽ��ʾ)��