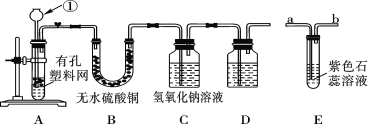
题目内容
【题目】大多数金属硫化物难溶于水,可溶于硝酸。例如:
①FeS +HNO3(稀)→Fe(NO3)3 +NO↑+S↓+H2O(未配平)
②CuS +HNO3(浓)→CuSO4 +NO2↑+H2O(未配平)
(1)配平反应②的方程式:
__CuS +__HNO3(浓)→__CuSO4 +__NO2↑+__H2O
(2)反应①中若生成3.2g硫,则电子转移___个。
(3)由反应①和②是否能够判断稀硝酸与浓硝酸的氧化性强弱?并说明判断依据。____。
(4)反应①和②所涉及的4种非金属元素中,原子半径由大到小的顺序是____;未成对电子最多的原子核外电子排布式为___。
下列描述,不能用来比较硫、氮两种元素的非金属性强弱的是___。
a.单质与氧气化合的难易程度 b.气态氢化物的稳定性
c.含氧酸的酸性强弱 d.S4N4中共用电子对的偏向
(5)写出①NO ②S ③H2O ④NO2四种物质的沸点由高到低的顺序(用编号回答)____。若要判断NO2分子的极性,你所需要的信息是___。
【答案】1 8 1 8 4 0.3NA或1.806×1023 能,反应①中稀硝酸将-2价的硫氧化到了低价态,而反应②中浓硝酸将-2价的硫氧化到了高价态 S>N>O>H 1s22s22p3 ac ②>③>④>① NO2分子的空间结构(或:NO2分子中正负电荷中心是否重合)
【解析】
(4)短周期元素有H、S、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小;未成对电子最多的原子为N原子;比较非金属性强弱,可根据氢化物的稳定性强弱、与氢气反应的剧烈程度、最高价氧化物的水化物的酸性强弱以及形成化合物的电子对偏向;
(5)S常温下为固体,H2O为液体,气体的相对分子质量越大,沸点越高;可根据分子的空间结构判断。
(1)反应中S元素化合价由-2价升高到+6价,N元素化合价由+5价降低到+4价,反应的方程式为CuS+8HNO3(浓)=CuSO4+8NO2↑+4H2O;
答案:1;8;1;8;4;
(2)n(S)=![]() =0.1mol,,消耗0.1molFeS,铁元素化合价由+2价升高到+3价,S元素化合价由-2价升高到0价,则电子转移0.3NA或1.806×1023
=0.1mol,,消耗0.1molFeS,铁元素化合价由+2价升高到+3价,S元素化合价由-2价升高到0价,则电子转移0.3NA或1.806×1023
答案: 0.3NA或1.806×1023
(3)一般来说,具有可变化合价的单质或化合物与不同氧化剂发生反应时,氧化剂的氧化性越强,则化合价升高数值越大,可比较氧化性强弱;
答案: 能,反应①中稀硝酸将-2价的硫氧化到了低价态,而反应②中浓硝酸将-2价的硫氧化到了高价态
(4)短周期元素有H、S、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,原子核外电子层数越多,原子半径越大,则原子半径S>N>O>H,未成对电子最多的原子为N原子,核外电子排布式为1s22s22p3;比较非金属性强弱,可根据氢化物的稳定性强弱、与氢气反应的剧烈程度、最高价氧化物的水化物的酸性强弱以及形成化合物的电子对偏向,ac符合;
答案: S>N>O>H 1s22s22p3 ac
(5)S常温下为固体,H2O为液体,气体的相对分子质量越大,沸点越高,①NO ②S ③H2O ④NO2;四种物质的沸点由高到低的顺序为②>③>④>①,判断二氧化氮是否非极性分子,可根据NO2分子的空间结构(或:NO2分子中正负电荷中心是否重合);答案: ②>③>④>① NO2分子的空间结构(或:NO2分子中正负电荷中心是否重合)。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚(CH3OCH3)等清洁燃料。由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1 kJ·mol-1
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3 kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示,则在10 min时,改变的外界条件可能是__________________________。

(2)反应③中ΔH3=_____________。800 ℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应③中正、逆反应速率的关系式是_________(填代号)。
a.v正>v逆 b.v正<逆 c.v正=v逆 d.无法判断
(3)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图像。___________

(4)某合成气的主要成分中的一氧化碳,在一定条件下也可用NaOH溶液与CO反应生成甲酸钠(HCOONa),进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L b mol·L-1NaOH溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数Ka=_________(用含a和b的代数式表示)。