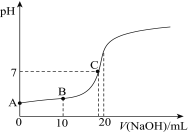
题目内容
【题目】相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是
A.pH相等的两溶液:c(CH3COO-)=c(Cl-)
B.等浓度的盐酸和醋酸中和相同物质的量的NaOH时,盐酸的体积小
C.同pH值时,稀释相同倍数后,醋酸溶液的pH值大
D.等pH值的盐酸和醋酸与铁粉反应,产生气体的速率盐酸快
【答案】A
【解析】
本题主要考查了弱电解质在水溶液中的电离平衡,注意强酸和弱酸的电离程度的区别。
相同条件下,醋酸为弱酸,存在可逆电离平衡,盐酸为强酸,能完全电离。
A.pH相等时,CH3COOH![]() CH3COO-+H+,HCl=H++Cl-电离出相同浓度的氢离子,c(CH3COO-)=c(Cl-),A正确;
CH3COO-+H+,HCl=H++Cl-电离出相同浓度的氢离子,c(CH3COO-)=c(Cl-),A正确;
B.中和相同物质的量的NaOH时,两者均为1:1反应,故体积相等,B错误;
C. 同pH值时,稀释相同倍数后,醋酸溶液电离平衡正向移动,氢离子物质的量增大,氢离子浓度的减小值小于盐酸,故盐酸pH大,C错误;
D.与铁粉反应时,溶液中的氢离子的物质的量浓度越大,则反应速率就越快。由于pH值相同,因此在反应前两种溶液中氢离子浓度是相等的,故在刚刚开始反应时,醋酸与盐酸生成的氢气的速率是相等的,在反应过程中,醋酸电离CH3COOH![]() CH3COO-+H+正向移动,故生成的氢气会比盐酸要快,D错误。
CH3COO-+H+正向移动,故生成的氢气会比盐酸要快,D错误。
答案为A。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。回答下列问题(相关数据如下):
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
Sr(OH)2 | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
ⅡA元素氢氧化物 | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 | ||||
25℃时饱和溶液浓度molL-1 | 8.00×10-6 | 5.00×10-4 | 2.00×10-2 | 6.00×10-2 | 2.00×10-1 | ||||
I.(1)SrO2中氧元素的化合价为___。Sr(OH)2的碱性比Mg(
(2)工业上可以用SrO与铝粉充分混合,在真空加热反应生成金属锶和3SrO8Al2O3,写出该反应的化学方程式___。
Ⅱ.以天青石(主要含有SrSO4和少量CaCO3杂质)生产Sr(OH)2xH2O的工艺如下:
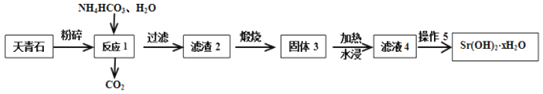
(3)滤渣2为混有CaCO3的SrCO3,写出生成SrCO3的化学方程式___。
(4)加热水浸固体3是为了获得较为纯净的Sr(OH)2涪液,此时应缓慢加热使沉淀颗粒长大,有利于___。
(5)从趁热过滤后的滤液中得到Sr(OH)2xH2O产品的步骤为降温结晶、过滤、洗涤、干燥。为得到较大颗粒的Sr(OH)2xH2O晶体,可采用的方法是___(填一种)。
(6)取m g纯净Sr(OH)2xH2O产品溶于水,加入过量纯碱溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=___(用含m、n的式子表示)。