题目内容
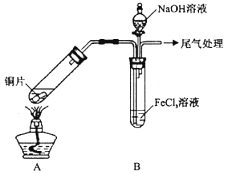
【题目】某校化学兴趣小组探究![]() 与
与![]() 溶液的反应,所用装置如下图所示
溶液的反应,所用装置如下图所示![]() 夹持仪器已略去
夹持仪器已略去![]() 。
。
![]() 实验室配制和保存
实验室配制和保存![]() 溶液应滴加少许______于试剂瓶中。
溶液应滴加少许______于试剂瓶中。
![]() 实验过程中需要配制
实验过程中需要配制![]()
![]() 溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、______。
溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、______。
![]() 该小组同学向5mL
该小组同学向5mL![]()
![]() 溶液中通入足量的
溶液中通入足量的![]() ,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是______。
,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是______。
![]() 该小组同学在
该小组同学在![]() 中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
(查阅资料)![]() 离子在溶液中呈红棕色且具有较强的还原性,能被
离子在溶液中呈红棕色且具有较强的还原性,能被![]() 氧化为
氧化为![]() 与
与![]() 溶液反应生成红棕色
溶液反应生成红棕色![]() 离子的离子方程式是______;
离子的离子方程式是______;![]() 与
与![]() 在溶液中反应的离子方程式是______。
在溶液中反应的离子方程式是______。
![]() 为了安全起见,还可以在A、B装置之间加一个______装置。
为了安全起见,还可以在A、B装置之间加一个______装置。
![]() 若实验中用5mL一定浓度的浓
若实验中用5mL一定浓度的浓![]() 与适量Cu片充分反应,实验结束后,测得产生
与适量Cu片充分反应,实验结束后,测得产生![]() 的体积在标准状况下为672mL,向已冷却的A试管溶液中加入
的体积在标准状况下为672mL,向已冷却的A试管溶液中加入![]() 的NaOH溶液30mL时,恰好使
的NaOH溶液30mL时,恰好使![]() 完全沉淀。则所用浓
完全沉淀。则所用浓![]() 浓度为______。
浓度为______。![]() 忽略过程中溶液的体积变化
忽略过程中溶液的体积变化![]()
【答案】稀盐酸 100mL的容量瓶 先无现象,后生成白色沉淀 ![]()
![]() 防倒吸
防倒吸 ![]()
【解析】
![]() 氯化铁溶液是强酸弱碱盐的溶液,铁离子水解生成氢氧化铁和盐酸;
氯化铁溶液是强酸弱碱盐的溶液,铁离子水解生成氢氧化铁和盐酸;
![]() 据配制一定物质的量浓度的溶液的步骤选择需要的仪器,计算、称量、溶解、冷却转移、洗涤转移、定容摇匀、静置得到;
据配制一定物质的量浓度的溶液的步骤选择需要的仪器,计算、称量、溶解、冷却转移、洗涤转移、定容摇匀、静置得到;
![]() 溶液中通人足量的
溶液中通人足量的![]() ,溶液最终呈浅绿色,为
,溶液最终呈浅绿色,为![]() 溶液,溶液显酸性;
溶液,溶液显酸性;
![]() 与
与![]() 溶液反应生成红棕色
溶液反应生成红棕色![]() 离子,
离子,![]() 离子可以将
离子可以将![]() 还原为
还原为![]() ,根据氧化还原反应特征书写离子方程式;
,根据氧化还原反应特征书写离子方程式;
![]() 间需要连接一个安全瓶,防止B中液体倒吸如A;
间需要连接一个安全瓶,防止B中液体倒吸如A;
![]() 的体积在标准状况下为672mL,物质的量为
的体积在标准状况下为672mL,物质的量为![]() ,根据电子得失守恒:
,根据电子得失守恒:![]() ,则
,则![]() ,完全沉淀
,完全沉淀![]() 需
需
要NaOH的物质的量为![]() ,
,![]() 为
为![]() ,即
,即![]() 为
为![]() ,而A试管溶液中加入
,而A试管溶液中加入![]() 的NaOH溶液30mL,即
的NaOH溶液30mL,即![]() ,说明反应后
,说明反应后![]() 过量,过量的
过量,过量的![]() 为
为![]() ,根据硫守恒可知5mL一定浓度的浓
,根据硫守恒可知5mL一定浓度的浓![]() 中含有
中含有![]() 共
共![]() ,最后根据
,最后根据![]() 来解答。
来解答。
![]() 实验室配制和保存
实验室配制和保存![]() 溶液应滴加少许稀盐酸抑制其水解,
溶液应滴加少许稀盐酸抑制其水解,
故答案为:稀盐酸;
![]() 配制
配制![]() 溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶,
溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、100mL的容量瓶,
故答案为:100mL的容量瓶;
![]() 溶液显酸性,滴入NaOH溶液时,开始无现象,然后产生白色沉淀,
溶液显酸性,滴入NaOH溶液时,开始无现象,然后产生白色沉淀,
故答案为:开始无现象,然后产生白色沉淀;
![]() 与
与![]() 溶液反应生成红棕色
溶液反应生成红棕色![]() 离子反应的离子方程式为:
离子反应的离子方程式为:![]() ,
,![]() 离子可以将
离子可以将![]() 还原为
还原为![]() ,则由氧化还原反应有升必有降,离子方程式为:
,则由氧化还原反应有升必有降,离子方程式为:![]() ;
;
故答案为:![]() ;
;![]() ;
;
![]() 为了安全起见,还可以在A、B装置之间加一个防倒吸的装置,
为了安全起见,还可以在A、B装置之间加一个防倒吸的装置,
故答案为:防倒吸;
![]() 的体积在标准状况下为672mL,物质的量为
的体积在标准状况下为672mL,物质的量为![]() ,根据电子得失守恒:
,根据电子得失守恒:![]() ,则
,则![]() ,完全沉淀
,完全沉淀![]() 需
需
要NaOH的物质的量为![]() ,
,![]() 为
为![]() ,即
,即![]() 为
为![]() ,而A试管溶液中加入
,而A试管溶液中加入![]() 的NaOH溶液30mL,即
的NaOH溶液30mL,即![]() ,说明反应后
,说明反应后![]() 过量,过量的
过量,过量的![]() 为
为![]() ,根据硫守恒可知5mL一定浓度的浓
,根据硫守恒可知5mL一定浓度的浓![]() 中含有
中含有![]() 共
共![]() ,其物质的量浓度为
,其物质的量浓度为![]() ;
;
故答案为:![]() 。
。

【题目】25 ℃时,几种常见弱酸的Ka如下表所示[已知草酸(H2C2O4)是一种二元弱酸]:
弱酸 | H2C2O4 | CH3COOH | HCN | H2CO3 |
Ka | K1=5.6×10-2 K2=5.4×10-5 | 1.8×10-5 | 6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
(1)25 ℃时,0.1 mol·L-1的Na2C2O4、CH3COONa、NaCN、Na2CO3溶液的pH由大到小的顺序是________________________,中和等体积等pH的CH3COOH和HCN溶液消耗NaOH的物质的量________(填“前者大”或“后者大”)。
(2)KHC2O4溶液呈酸性。向10 mL 0.01 mol·L-1的H2C2O4溶液滴加0.01 mol·L-1KOH溶液V(mL),回答下列问题:
①当V<10 mL时,反应的离子方程式为________________________________。
②当V=10 mL时,溶液中HC2O![]() 、C2O
、C2O![]() 、H2C2O4、H+的浓度从大到小的顺序为_____________________。
、H2C2O4、H+的浓度从大到小的顺序为_____________________。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O![]() )+c(HC2O
)+c(HC2O![]() );当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O
);当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(H2C2O4);则a________(填“<”“=”或“>”)b。
)+c(H2C2O4);则a________(填“<”“=”或“>”)b。
④当V=20 mL时,再滴入NaOH溶液,则溶液中n(K+)/n(C2O![]() )的值将________(
)的值将________(

