题目内容
【题目】如图是某温度下,将足量的BaSO4固体溶于一定量水中达到溶解平衡后,假定溶液体积不变的情况下,加入Na2CO3使c(CO32-)增大过程中,溶液中c(Ba2+)和c(SO42-)的变化曲线。根据图中的数据分析,下列说法正确的是:
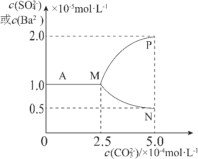
A.该温度下BaSO4的Ksp=2.5×10-9mol2·L-2
B.图中表示c(Ba2+)的曲线是MP
C.反应BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)的平衡常数K=0.04
BaCO3(s)+SO42-(aq)的平衡常数K=0.04
D.如用1LNa2CO3溶液将0.1molBaSO4固体完全转化为BaCO3,则原Na2CO3溶液浓度至少为2.5mol·L-1
【答案】C
【解析】
对于BaSO4的饱和溶液,![]() ,且
,且![]() ;由图可知,AM段,
;由图可知,AM段,![]() ,所以Ksp(BaSO4)=10-10。当加入的
,所以Ksp(BaSO4)=10-10。当加入的![]() 浓度大于2.5×10-4mol/L时,纵轴表示的Ba2+和
浓度大于2.5×10-4mol/L时,纵轴表示的Ba2+和![]() 浓度不再相等,说明M点BaSO4开始转变为BaCO3沉淀,M点即BaCO3恰好开始生成沉淀的点。若要把BaSO4固体全部转变成BaCO3,除了要保证足量的
浓度不再相等,说明M点BaSO4开始转变为BaCO3沉淀,M点即BaCO3恰好开始生成沉淀的点。若要把BaSO4固体全部转变成BaCO3,除了要保证足量的![]() 与Ba2+结合外,还要保证溶液中
与Ba2+结合外,还要保证溶液中![]() 和
和![]() 达到平衡关系。
达到平衡关系。
A.通过分析可知,Ksp(BaSO4)=10-10,A项错误;
B.加入碳酸钠使硫酸钡转化为碳酸钡,那么溶液中的![]() 的浓度会逐渐增大,所以曲线MP表示的是
的浓度会逐渐增大,所以曲线MP表示的是![]() ,MN表示的才是Ba2+,B项错误;
,MN表示的才是Ba2+,B项错误;
C.该反应的平衡常数表达式为: ,C项正确;
,C项正确;
D.若要将0.1molBaSO4转变为BaCO3,结合C中的分析可知,转化完毕最终溶液中有:![]() ,所以除了BaCO3沉淀中的0.1mol
,所以除了BaCO3沉淀中的0.1mol![]() ,溶液中还有2.5mol
,溶液中还有2.5mol![]() ,因此需要的
,因此需要的![]() 最少为2.6mol,所以需要的1LNa2CO3溶液的最小浓度为2.6mol/L,D项错误;
最少为2.6mol,所以需要的1LNa2CO3溶液的最小浓度为2.6mol/L,D项错误;
答案选C。

练习册系列答案
相关题目