题目内容
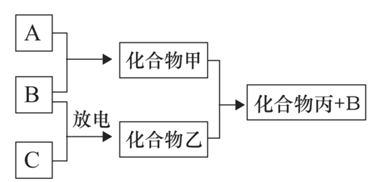
【题目】全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。下列说法不正确的是

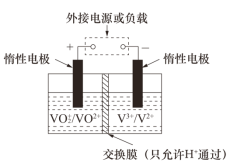
A.放电过程中右槽溶液颜色逐渐由紫色变为绿色
B.放电过程中氢离子的作用之一是参与正极反应
C.充电过程中左槽溶液逐渐由蓝变黄
D.充电时若转移的电子数为3.01![]() 1023个,左槽溶液中n(H+)的变化量为1mol
1023个,左槽溶液中n(H+)的变化量为1mol
【答案】D
【解析】
由电池原理示意图可知,左边的电极为电池的正极,充电时做阳极;右边的电极为电池的负极,充电时做阴极。
A.放电时,右边的电极为负极,所以右边发生氧化反应即由V2+转变为V3+的反应,颜色变化为:紫色变绿色,A项正确;
B.放电时,左边的电极为正极,电极反应式为:![]() ,B项正确;
,B项正确;
C.充电时,左边电极为阳极,发生氧化反应即由![]() 转变为
转变为![]() 的反应,颜色变化为:蓝色变黄色,C项正确;
的反应,颜色变化为:蓝色变黄色,C项正确;
D.充电时,左槽发生的电极反应式为:![]() ,若转移3.01×1023个电子,即0.5mol电子,那么生成H+1mol,同时从左槽到右槽由0.5mol的H+发生迁移;所以整个过程,左槽n(H+)变化量为0.5mol,D项错误;
,若转移3.01×1023个电子,即0.5mol电子,那么生成H+1mol,同时从左槽到右槽由0.5mol的H+发生迁移;所以整个过程,左槽n(H+)变化量为0.5mol,D项错误;
答案选D。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】H2C2O4为二元弱酸,且具有还原性。
Ⅰ.20℃时,改变0.1mol·L-1H2C2O4溶液的pH,溶液中的H2C2O4、HC2O4—、C2O42—的物质的量分数δ(X)随pH的变化如图所示。
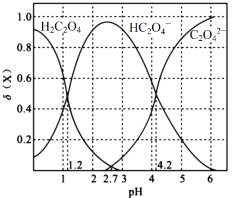
已知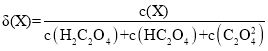
(1)Ka1(H2C2O4)=___________。
(2)0.1mol·L-1NaHC2O4溶液中离子浓度由大到小的顺序是___________。
(3)已知20℃时K(HCOOH)=1.77×10-4,向HCOONa溶液中加入少量H2C2O4,反应的离子方程式是___________。
Ⅱ.KMnO4溶液常用作氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,因此使用前须用H2C2O4·2H2O配制的标准溶液标定(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)。
(4)准确量取一定体积的KMnO4溶液需要使用的仪器是____________。
(5)某学生根据3次实验分别记录有关数据如表所示,该KMnO4溶液的物质的量浓度为___________mol·L-1。
实验序号 | 消耗0.1000mol·L-1的H2C2O4溶液的体积/mL | 待测KMnO4溶液的体积/mL |
1 | 29.90 | 25.00 |
2 | 30.00 | 25.00 |
3 | 30.10 | 25.00 |
(6)在上述滴定过程中,下述操作可导致被测定的KMnO4浓度偏高的是___________
a.未用标准液润洗滴定管
b.达到滴定终点,读数时俯视液面
c.盛装待测液的锥形瓶用蒸馏水洗过,未润洗
d.滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失
【题目】氢气是一种清洁能源。科学家探究太阳能制氢技术,设计流程图如图:
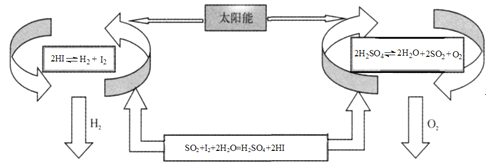
信息提示:以下反应均在150℃发生
2HI(aq)H2(g)+I2(g) △H1
SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) △H2
2H2SO4(l)2H2O(g)+2SO2(g)+O2(g) △H3
2H2O(g)=2H2(g)+O2(g) △H4
请回答下列问题:
(1)△H4与△H1、△H2、△H3之间的关系是:△H4= ______ 。
(2)该制氢气技术的优点是 ______ ,若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H ______ 0(填“>”,“<”或“=”)。
(3)在某温度下,H2SO4在不同催化剂条件下分解产生氧气的量随时间变化如图所示,则下列说法正确的是 ______。
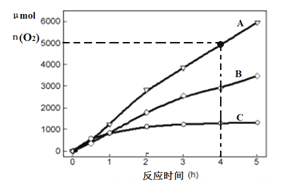
A H2SO4分解反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B 若在恒容绝热的密闭容器中发生反应,当K值不变时,说明该反应已经达到平衡
C 0~4小时在A催化剂作用下,H2SO4分解的平均速率v(O2)=1250molh-1
D 不同催化剂的催化效果不同,是因为活化分子百分数不相同
(4)对于反应:2HI(g)H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数 K的计算式为: ______ 。
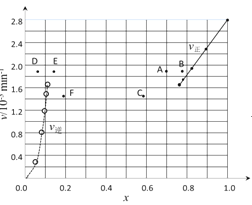
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 ______ (以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正= ______ min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 ______ (填字母)。