题目内容
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
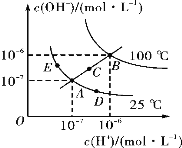
A.图中三点对应水电离出氢离子浓度关系:E<A<D
B.若从A点到E点,可采用温度不变,向水中加入适量的NaAc固体
C.图中三点对应离子积关系:B>C>A
D.当处在B点时,将pH=3的硫酸与pH=11的KOH溶液等体积混合后,溶液显中性
【答案】D
【解析】
A.E、A、D三点均在同一曲线上,因此根据图像可知图中三点对应水电离出氢离子浓度关系:E<A<D,A正确;
B.从A点到E点氢离子浓度减小,氢氧根浓度增大,醋酸钠水解溶液显碱性,则从A点到E点,可采用温度不变,向水中加入适量的NaAc固体来实现,B正确;
C.水的电离吸热,加热促进电离,从A→C→B温度升高,水的电离程度增大,因此图中三点对应离子积关系:B>C>A,C正确;
D.B点Kw=10-12,中性溶液pH=6;将pH=3的硫酸(氢离子浓度是10-3mol/L)与pH=11的KOH溶液(氢氧根浓度是0.1mol/L)等体积混合后,KOH过量,溶液显碱性,D错误;
故答案为D。

 口算能手系列答案
口算能手系列答案【题目】现有下列九种物质:①H2 ②铝 ③Na2O2 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
分类标准 | 能导电 | 非电解质 | 电解质 |
属于该类的物质 | ___ | ___ | ___ |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___。
(3)过量的⑦滴加到⑨的溶液中的离子方程式为___,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为___。
(4)④与③充分反应的化学方程式为:___,当转移NA电子,生成标况下气体的体积为___。
(5)②与⑧发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是___(填化学式),还原剂与氧化剂的物质的量之比是___,当有5.4gAl发生反应时,转移电子的物质的量为___。