题目内容
【题目】现有73 g HCl气体,若阿伏加德罗常数用NA表示,则:
(1)HCl气体的物质的量为_______mol。
(2)HCl气体所含原子总数为_______个。
(3)HCl气体在标准状况下的体积为________L。
(4)HCl气体溶于水后形成2 L溶液,其溶液的物质的量浓度为_________mol/L。
【答案】2 4NA 44.8 1
【解析】
(1)氯化氢气体的摩尔质量为36.5g·mol-1,73g HCl气体的物质的量=![]() =2mol,故答案为:2;
=2mol,故答案为:2;
(2)原子物质的量为2mol×2=4mol,故含有原子数目为4NA,故答案为:4NA;
(3)标况下,HCl的体积=2mol×22.4L·mol-1=44.8L,故答案为:44.8;
(4)溶于水后形成2L溶液,所得溶液物质的量浓度=![]() =1mol/L。
=1mol/L。

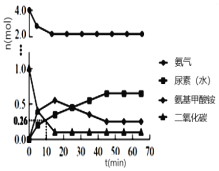
【题目】(1)在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,发生反应2NO2(g)![]() N2O4(g)ΔH<0。反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示。
N2O4(g)ΔH<0。反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示。
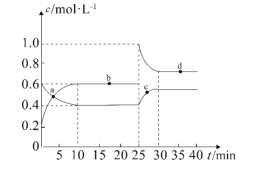
①0~10min的平均反应速率:v((NO2)=___________mol·L-1·min-1。
②a、b、c、d四个点中,表示化学反应速率v(正)>v(逆)的点是___________。
③上述反应反应进行到25min时,继续向容器内充入一定量NO2,重新达到平衡后,混合气体中NO2的体积分数将___________(填“增大”“不变”或“减小”)。该反应的平衡常数K=___________(计算结果保留1位小数)。
(2)一定温度下恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g),在碘蒸气存在时能大幅度提高N2O的分解速率,反应历程为:
2N2(g)+O2(g),在碘蒸气存在时能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___________(填标号)。
a.N2O分解反应中,k(含碘)>k(无碘)b.第一步对总反应速率起决定作用
c.第二步活化能比第三步大d.I2浓度与N2O分解速率无关
(3)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
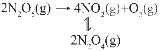
其中NO2二聚为N2O4的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 36.0 | 40.5 | 42.6 | 45.9 | 49.2 | 61.2 | 62.3 | 64.0 |
①25℃时2NO2(g)![]() N2O4(g)反应的平衡常数Kp=___________kPa-1。
N2O4(g)反应的平衡常数Kp=___________kPa-1。
②t=200min时,测得体系中p(N2O4)=6.5kPa,则此时的N2O5转化率为___________。(计算结果保留1位小数)