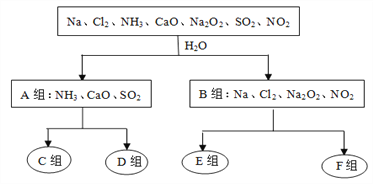
题目内容
【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2)。为了制取氯气并进行氯气的性质实验,其装置如图所示,请回答下列问题:

(1)取适量软锰矿置于烧瓶中,加入足量浓盐酸并加热,烧瓶中发生的化学反应为:MnO2 +4HCl(浓)![]() MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
(2)若将干燥的有色布条放入C中,观察到的现象是 ______ ,原因是 ______________ (用化学方程式和文字回答);
(3)实验中观察到D溶液变蓝色,写出D装置中发生反应的离子方程式 ____________ ;
(4)为探究氯气与Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
实验方法 | 实验现象 | 实验结论 |
1.取反应初始阶段(氯气不足量)F中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液装入两只试管中,①加入KSCN溶液,②加入KMnO4溶液 | ①KSCN溶液显红色 ②KMnO4溶液不褪色 | (不填) |
2.取充分反应后(氯气通入足够长时间)F中产物,溶于水中,加入KMnO4溶液 | KMnO4溶液不褪色 |
根据实验现象,得出实验结论,写出氯气与Fe粉共热时发生反应的化学方程式______;
(5)已知F中的产物易潮解,在F和H装置之间安装G装置,目的是_________________。
【答案】 SiO2 小于 酸性和还原性 有色布条褪色 Cl2+H2O=HCl+HClO,HClO具有漂白性,能使有色布条褪色 2I-+Cl2=I2+2Cl- 2Fe+3Cl2![]() 2FeCl3 防止H中的水蒸气进入到F装置中(或者吸收H中挥发出来的水蒸气)
2FeCl3 防止H中的水蒸气进入到F装置中(或者吸收H中挥发出来的水蒸气)
【解析】(1)软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2),二氧化锰能够与浓盐酸反应生成氯化锰溶液、氯气和水,二氧化硅与盐酸不反应,所以剩余固体为二氧化硅;由于随着反应的进行浓盐酸变稀,稀盐酸与二氧化锰不反应,因此若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积小于22.4L,由于反应中还有氯化锰生成,则浓盐酸在该反应中表现出来的性质是酸性和还原性;(2)氯气溶于水:Cl2+H2O=HCl+HClO,HClO具有漂白性,能使有色布条褪色;(3)实验中观察到D中溶液变蓝色,说明有单质碘生成,即氯气将碘化钾氧化为单质碘,发生反应的离子方程式为2I-+Cl2=I2+2Cl-;(4)过量的铁和氯气反应后的固体,用磁铁除去过量的Fe,溶于水,加入KSCN溶液,溶液变红色,加入KMnO4溶液,溶液不褪色,铁和氯气反应与铁的量无关,反应生成氯化铁,因此氯气与Fe粉共热时发生反应的化学方程式为2Fe+3Cl2![]() 2FeCl3;(5)已知F中的产物易潮解,在F和H装置之间安装G装置,目的是防止H中的水蒸气进入到F装置中(或者吸收H中挥发出来的水蒸气)。
2FeCl3;(5)已知F中的产物易潮解,在F和H装置之间安装G装置,目的是防止H中的水蒸气进入到F装置中(或者吸收H中挥发出来的水蒸气)。

【题目】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
元素 | 相关信息 |
A | 原子核外L层电子数是K层的2倍 |
B | 其一种单质被称为地球生物的“保护伞” |
C | 元素的第一电离能是第3周期所有元素中最小的 |
D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是 .
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) , B、D的简单氢化物中稳定性较大的是 .
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为;该化合物属于晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: .