题目内容
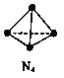
【题目】N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 molN-N键吸收193kJ能量,形成N2(g)中1 mol N![]() N放出941 kJ能量。下列说法正确的是
N放出941 kJ能量。下列说法正确的是
A. N4(g)比N2(g)更稳定
B. N4(g)=2N2(g) △H=+724kJmol-1
C. 形成1 mol N4(g)中的化学键放出193 kJ的能量
D. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
【答案】D
【解析】从结构图中可看出,一个N4分子中含有6个N-N键,根据N4(g)=2N2(g)△H,有△H=6×193 kJmol-1-2×941 kJmol-1=-724 kJmol-1。A.根据上述分析,N4比N2的能量高,没有N2的稳定,故A错误;B.根据上述分析,N4(g)=2N2(g)△H=-724 kJmol-1,故B错误;C.一个N4分子中含有6个N-N键,形成1 mol N4(g)中的化学键放出6×193 kJ的能量,故C错误;D.根据上述分析,lmolN2(g)完全转化为N4(g),需要吸收362kJ的热量,体系的能量增加362kJ,故D正确;故选D。
点晴:本题考查反应热与化学键键能的关系。注意从物质能量、键能角度理解反应热,明确反应热的焓变△H=反应物总键能-生成物总键能以及焓变的正负与吸收、放出热量的关系是解答的关键。本题的易错点为C,要注意一个N4分子中含有6个N-N键。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


