题目内容
【题目】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
元素 | 相关信息 |
A | 原子核外L层电子数是K层的2倍 |
B | 其一种单质被称为地球生物的“保护伞” |
C | 元素的第一电离能是第3周期所有元素中最小的 |
D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是 .
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) , B、D的简单氢化物中稳定性较大的是 .
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为;该化合物属于晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: .
【答案】
(1)三;IA;1s22s22p63s23p4
(2)S2﹣>O2﹣>Na+;H2O
(3)离子键、共价键;离子
(4)3Fe3O4+8Al ![]() 9Fe+4Al2O3
9Fe+4Al2O3
(5)2CO(g)+SO2(g)=S(s)+2CO2(g)△H=﹣270kJ?mol﹣1
【解析】解:A元素原子核外L层电子数是K层的2倍,则L层有4个电子,故A为碳元素;B元素的一种单质被称为地球生物的“保护伞”,故B为氧元素;C元素的第一电离能是第3周期所有元素中最小的,故C为Na元素;D元素基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) , 由于n=2,故D为S元素;E元素可形成多种氧化物,其中一种为具有磁性的黑色晶体,故E为Fe元素.
(1.)C为Na元素,处于周期表中第三周期IA族,D为硫元素,基态原子核外电子排布式是1s22s22p63s23p4 , 所以答案是:三、IA;1s22s22p63s23p4;
(2.)B、C、D的简单离子分别为O2﹣、Na+、S2﹣ , 电子层排布相同,核电荷数越大离子半径越小,最外层电子数相同,电子层越多离子半径越大,故离子半径由大到小的顺序为:S2﹣>O2﹣>Na+ , 由于非金属性O>S,故气态氢化物中稳定性H2O>H2S,所以答案是:S2﹣>O2﹣>Na+;H2O;
(3.)B、C的单质按物质的量比1:2形成的化合物为Na2O2 , 含有离子键、共价键,属于离子晶体,所以答案是:离子键、共价键;离子;
(4.)E的黑色磁性晶体为Fe3O4 , 发生铝热反应的化学方程式是:3Fe3O4+8Al ![]() 9Fe+4Al2O3 , 所以答案是:3Fe3O4+8Al
9Fe+4Al2O3 , 所以答案是:3Fe3O4+8Al ![]() 9Fe+4Al2O3;
9Fe+4Al2O3;
(5.)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:①、2CO(g)+O2(g)=2CO2(g)△H=﹣566.0kJmol﹣1 , ②、S(s)+O2(g)=SO2(g)△H=﹣296.0kJmol﹣1 , 由盖斯定律,①﹣②得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=(﹣566.0kJmol﹣1)﹣(﹣296.0kJmol﹣1)=﹣270kJmol﹣1 , 所以答案是:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=﹣270kJmol﹣1 .

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2)。为了制取氯气并进行氯气的性质实验,其装置如图所示,请回答下列问题:
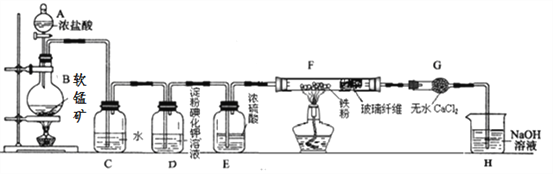
(1)取适量软锰矿置于烧瓶中,加入足量浓盐酸并加热,烧瓶中发生的化学反应为:MnO2 +4HCl(浓)![]() MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
(2)若将干燥的有色布条放入C中,观察到的现象是 ______ ,原因是 ______________ (用化学方程式和文字回答);
(3)实验中观察到D溶液变蓝色,写出D装置中发生反应的离子方程式 ____________ ;
(4)为探究氯气与Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
实验方法 | 实验现象 | 实验结论 |
1.取反应初始阶段(氯气不足量)F中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液装入两只试管中,①加入KSCN溶液,②加入KMnO4溶液 | ①KSCN溶液显红色 ②KMnO4溶液不褪色 | (不填) |
2.取充分反应后(氯气通入足够长时间)F中产物,溶于水中,加入KMnO4溶液 | KMnO4溶液不褪色 |
根据实验现象,得出实验结论,写出氯气与Fe粉共热时发生反应的化学方程式______;
(5)已知F中的产物易潮解,在F和H装置之间安装G装置,目的是_________________。