题目内容
反应 A + B→C + Q分两步进行 ①A + B→X - Q;②X→C + Q。下列示意图中,能正确表示总反应过程中能量变化的是
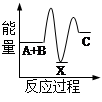 | 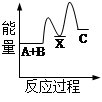 | 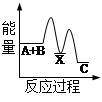 | 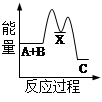 |
| A | B | C | D |
D
解析试题分析:根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答。由反应A + B→C + Q分两步进行 ①A + B→X - Q;②X→C + Q可以看出,A+B→C是放热反应,A和B的能量之和大于C,由①A+B→X可知这步反应是吸热反应,X→C是放热反应,故X的能量大于A+B;A+B的能量大于C;X 的能量大于C,因此图象D符合,答案选D。
考点:考查反应热的判断、计算以及图像识别等

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量,则下列说法正确的是( )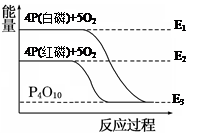
| A.白磷比红磷稳定 |
| B.白磷燃烧是吸热反应 |
| C.红磷转变为白磷是吸热反应 |
| D.红磷燃烧的热化学方程式:4P(s) + 5O2(g)=P4O10(s) ΔH=(E2-E3)kJ/mol |
下列说法正确的是
| A.甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g)△H=" -890.3" kJ/mol |
B.500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: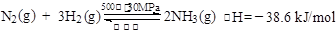 |
C.已知:2CO(g)+O2(g) ===2CO2(g)ΔH=" -566" kJ/mol,下图可表示由CO生成CO2的反应过程和能量关系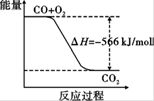 |
| D.已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F 、S-F键需吸收的能量分别为160 kJ、330 kJ。已知1个 SF6(g)分子中含有6条S-F键。则:S(s)+3F2(g) ===SF6(g) △H=-1220 kJ/mol |
已知2H2(g)+O2(g) →2H2O(l)+571.6kJ,2H2(g)+O2(g) →2H2O(g)+483.6kJ。下列说法正确的是
| A.2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 |
| B.1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 |
| C.1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 |
| D.等质量的H2O (g)比H2O(l)所含能量低 |
已知Zn(s)+ H2SO4(aq)= ZnSO4(aq)+ H2(g) ΔH<0;则下列叙述不正确的是
| A.该反应的ΔH值与反应物用量无关 |
| B.该反应的化学能可以转化为电能 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量 |
下列关于化学反应的描述中正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.已知NaOH(aq) +HCI(aq) =NaCI(aq)+H2O(1) △H= 一57.3 kJ·mol-1, 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 |
| C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为 2CO (g)+ O2(g)=2CO2(g) △H=一283.0 kJ·mol-1 |
| D.已知2C(s) +2O2(g)=2CO2(g) △H=a, 2C(s) +O2(g)="2CO" (g) △H=b,则b>a |
下列图示与对应的叙述相符的是
| A.图I表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是增加了SO2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是增加了SO2 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时铝离子恰好沉淀完全 |
| D.电导率可表示溶液导电性的强弱,电导率越大导电性越强。图Ⅳ可表示向盐酸和醋酸混合溶液中滴入氨水过程中电导率的变化关系 |
反应3X(g)+Y(g) 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为( )
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为( )
| A.v(X)=0.05mol·L-1·min-1 | B.v(Z)= 0.10mol·L-1·min-1 |
| C.v(Y)=0.10mol·L-1·min-1 | D.v(W)=0.05mol·L-1·s-1 |
36g碳不完全燃烧所得气体中,CO占三分之一体积,CO2占三分之二体积。已知:2C(s)+O2(g)=2CO(g)△H=-110.5kJ/mol,2CO(g)+O2(g) =2CO2(g)△H=-566kJ/mol,与这些碳完全燃烧相比,损失的热量是( )
| A.172.5kJ | B.1149kJ | C.517.5kJ | D.283kJ |