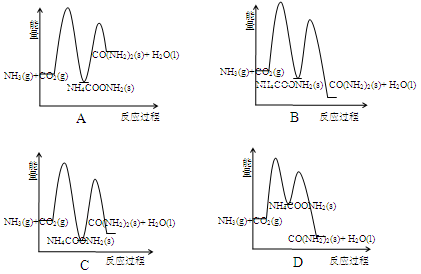
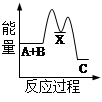题目内容
已知2H2(g)+O2(g) →2H2O(l)+571.6kJ,2H2(g)+O2(g) →2H2O(g)+483.6kJ。下列说法正确的是
| A.2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 |
| B.1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 |
| C.1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 |
| D.等质量的H2O (g)比H2O(l)所含能量低 |
B
解析试题分析:A.2 molH2(g)和1molO2(g)的总能量大于2mol H2O (l)的能量,该反应为放热反应;B.根据盖斯定律,反应的吸放热只跟始态和终态有关,和反应途径无关,1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量;C.1mol H2O (l)变成1mo1 H2O (g),吸收44kJ能量;D.等质量的H2O (g)比H2O(l)所含能量高,同一物质的气态要比液态的能量高。
考点:考查盖斯定律和热化学方程式的相关计算。

练习册系列答案
相关题目
CO(g)+H2O(g) H2(g)+CO2(g)<0,在其他条件不变的情况下:
H2(g)+CO2(g)<0,在其他条件不变的情况下:
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1 则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b |
已知25℃、10lkPa条件下: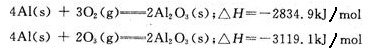
由此得出的正确结论是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.等质量的O2比O3能量低,由O2变O3为放热反应 |
| C.O3比O2稳定,由O2变O3为吸热反应 |
| D.O2比O3稳定,由O2变O3为放热反应 |
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是 ( )
A.碳酸钠的水解反应:CO32-+H2O  HCO3-+OH- HCO3-+OH- |
B.FeCl3水解的离子方程式:Fe3++3H2O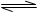 Fe (OH)3+3H+ Fe (OH)3+3H+ |
| C.稀溶液中强酸与强碱的中和热:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ· mol-1 |
| D.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g)△H = 110.5kJ·mol-1 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是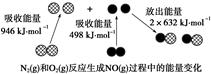
| A.1molN2(g)和NA个O2(g)反应放出的能量为180kJ |
| B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A.金刚石与石墨互为同位素 |
| B.石墨不如金刚石稳定 |
| C.金刚石与石墨互为同分异构体 |
| D.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多 |