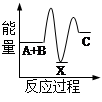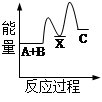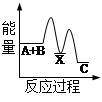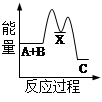题目内容
反应3X(g)+Y(g) 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为( )
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为( )
| A.v(X)=0.05mol·L-1·min-1 | B.v(Z)= 0.10mol·L-1·min-1 |
| C.v(Y)=0.10mol·L-1·min-1 | D.v(W)=0.05mol·L-1·s-1 |
B
解析试题分析:先由n(Y)的变化量求5min内Y的变化浓度,再由平均反应速率定义式求Y表示的平均反应速率,最后根据其余反应物和生成物与Y的系数之比等于速率之比求其余物质表示的平均反应速率。依题意,v(Y)=" 0.5mol" ÷2L÷5min="0.05" mol·L-1·min-1,故C错;由于反应3X(g)+Y(g) 2Z(g)+2W(g)中X与Y的系数之比等于速率之比,则v(X)="3" v(Y)=" 0.15" mol·L-1·min-1,故A错;由于反应3X(g)+Y(g)
2Z(g)+2W(g)中X与Y的系数之比等于速率之比,则v(X)="3" v(Y)=" 0.15" mol·L-1·min-1,故A错;由于反应3X(g)+Y(g) 2Z(g)+2W(g)中Z与Y的系数之比等于速率之比,则v(Z)="2" v(Y)=" 0.10" mol·L-1·min-1,故B正确;由于反应3X(g)+Y(g)
2Z(g)+2W(g)中Z与Y的系数之比等于速率之比,则v(Z)="2" v(Y)=" 0.10" mol·L-1·min-1,故B正确;由于反应3X(g)+Y(g) 2Z(g)+2W(g)中W与Y的系数之比等于速率之比,则v(W)="2" v(Y)=" 0.10" mol·L-1·min-1,故D错。
2Z(g)+2W(g)中W与Y的系数之比等于速率之比,则v(W)="2" v(Y)=" 0.10" mol·L-1·min-1,故D错。
考点:考查平均反应速率的计算,涉及某气态物质变化的物质的量、容器的容积、气态物质的变化浓度、平均反应速率的定义式、化学方程式中系数之比等于速率之比(或变化浓度之比、变化的物质的量之比)、不同物质表示的平均反应速率的计算等。

下列依据热化学方程式得出的结论正确的是
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1 则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b |
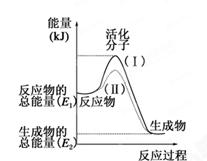
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是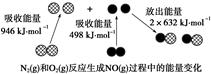
| A.1molN2(g)和NA个O2(g)反应放出的能量为180kJ |
| B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
下列反应中,生成物的总能量大于反应物的总能量的是
| A.氢气在氧气中燃烧 | B.焦炭在高温下与水蒸气反应 |
| C.铝与三氧化二铁高温反应 | D.铁丝在氧气中燃烧 |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A.金刚石与石墨互为同位素 |
| B.石墨不如金刚石稳定 |
| C.金刚石与石墨互为同分异构体 |
| D.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g) 2NH3(g) △H=" —92.4" kJ·mol-1,下列结论正确的是
2NH3(g) △H=" —92.4" kJ·mol-1,下列结论正确的是
| A.该反应达到平衡时,放出的热量等于92.4kJ |
| B.达到平衡后向容器中通入1mol氦气,平衡不移动 |
| C.降低温度和缩小容器体积均可使该反应的平衡常数增大 |
| D.若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |