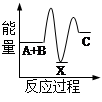题目内容
下列图示与对应的叙述相符的是
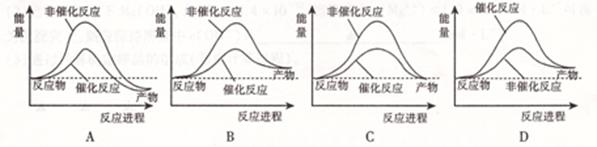
| A.图I表示某放热反应在无催化剂(a)和有催化剂(b)时反应的能量变化 |
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是增加了SO2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是增加了SO2 |
| C.图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时铝离子恰好沉淀完全 |
| D.电导率可表示溶液导电性的强弱,电导率越大导电性越强。图Ⅳ可表示向盐酸和醋酸混合溶液中滴入氨水过程中电导率的变化关系 |
A
解析试题分析:A、图I中反应物总能量大于生成物总能量,因此是放热反应。催化剂是通过降低反应活化能来改变反应速率,但不能改变平衡,故A正确;B、反应2SO2+O2 2SO3达到平衡时,依据图Ⅱ分析t2时刻二氧化硫和氧气物质的量减小,三氧化硫物质的量增大,这说明平衡向正反应方向进行,因此改变的条件是增大压强或降低温度。如果是增加了SO2,则SO2的物质的量不可能减少,即平衡时SO2的物质的量应该大于原平衡时SO2的物质的量,故B错误;C、开始生成BaSO4和Al(OH)3沉淀,中间继续生成BaSO4,但Al(OH)3开始溶解,所以质量增加变慢,最后都是BaSO4沉淀,沉淀质量不再变化,总的反应方程式:KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O,故C错误;D、向盐酸和醋酸混合溶液中滴入氨水发生反应生成强电解质氯化铵和醋酸铵,继续滴加氨水,导电能力几乎不再发生变化,故D错误,答案选A。
2SO3达到平衡时,依据图Ⅱ分析t2时刻二氧化硫和氧气物质的量减小,三氧化硫物质的量增大,这说明平衡向正反应方向进行,因此改变的条件是增大压强或降低温度。如果是增加了SO2,则SO2的物质的量不可能减少,即平衡时SO2的物质的量应该大于原平衡时SO2的物质的量,故B错误;C、开始生成BaSO4和Al(OH)3沉淀,中间继续生成BaSO4,但Al(OH)3开始溶解,所以质量增加变慢,最后都是BaSO4沉淀,沉淀质量不再变化,总的反应方程式:KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O,故C错误;D、向盐酸和醋酸混合溶液中滴入氨水发生反应生成强电解质氯化铵和醋酸铵,继续滴加氨水,导电能力几乎不再发生变化,故D错误,答案选A。
考点:考查反应热的判断、外界条件对平衡状态的影响、明矾与氢氧化钡反应以及溶液导电能力判断等

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是 ( )
A.碳酸钠的水解反应:CO32-+H2O  HCO3-+OH- HCO3-+OH- |
B.FeCl3水解的离子方程式:Fe3++3H2O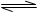 Fe (OH)3+3H+ Fe (OH)3+3H+ |
| C.稀溶液中强酸与强碱的中和热:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ· mol-1 |
| D.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g)△H = 110.5kJ·mol-1 |
能源是当今社会发展的三大支柱之一。有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为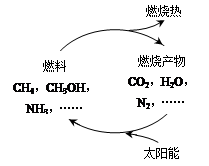
| A.化学能 | B.热能 |
| C.生物能 | D.电能 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是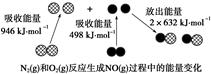
| A.1molN2(g)和NA个O2(g)反应放出的能量为180kJ |
| B.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
下列反应中,生成物的总能量大于反应物的总能量的是
| A.氢气在氧气中燃烧 | B.焦炭在高温下与水蒸气反应 |
| C.铝与三氧化二铁高温反应 | D.铁丝在氧气中燃烧 |
 2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是
2B(g);△H,若正反应的活化能为EakJ·mol-1,逆反应的活化能为EbkJ·mol-1,则△H =(Ea-Eb)kJ·mol-1。其归纳正确的是