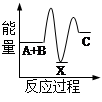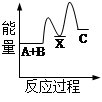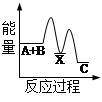题目内容
36g碳不完全燃烧所得气体中,CO占三分之一体积,CO2占三分之二体积。已知:2C(s)+O2(g)=2CO(g)△H=-110.5kJ/mol,2CO(g)+O2(g) =2CO2(g)△H=-566kJ/mol,与这些碳完全燃烧相比,损失的热量是( )
| A.172.5kJ | B.1149kJ | C.517.5kJ | D.283kJ |
D
解析试题分析:根据题意可知,碳损失的热量,就相当于是CO在燃烧时放出的热量。36g碳的物质的量为36g÷12g/mol=3mol,所以CO的物质的量为3mol×1/3=1mol。由于CO(g)+1/2O2(g)=CO2(g) △H=-283kJ/mol,所以1molCO燃烧放出的热量为283kJ/mol×1mol=283kJ,即36g碳不完全燃烧生成1molCO损失的热量为283kJ,答案选D。
考点:考查反应热的计算
点评:该题主要是考查学生对反应热含义以及反应热计算的熟悉了解程度,旨在培养学生的应试能力,提高学生的学习效率。该题的关键在于清楚碳不完全燃烧损失的热量为生成的一氧化碳燃烧放出的热量,然后结合题意灵活运用即可。

 阅读快车系列答案
阅读快车系列答案下列反应中,生成物的总能量大于反应物的总能量的是
| A.氢气在氧气中燃烧 | B.焦炭在高温下与水蒸气反应 |
| C.铝与三氧化二铁高温反应 | D.铁丝在氧气中燃烧 |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石时,要吸收EkJ的能量,下列说法正确的是( )
| A.金刚石与石墨互为同位素 |
| B.石墨不如金刚石稳定 |
| C.金刚石与石墨互为同分异构体 |
| D.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
化学反应H2+Cl2===2HCl的能量变化如图所示,则下列说法正确的是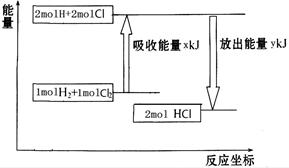
| A.该反应是放热反应 |
| B.断裂1 mol H—H键和1 mol Cl—Cl 键放出x kJ能量 |
| C.断裂1 mol H—Cl键需要吸收y kJ的能量 |
| D.2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |
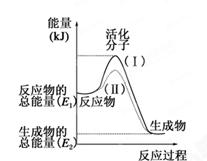
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0 kJ/mol
② CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ/mol
下列说法正确的是
| A.CH3OH的燃烧为吸热反应 |
B.反应①中的能量变化如图所示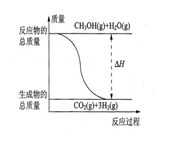 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H >-192.9kJ/mol |
(1)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示,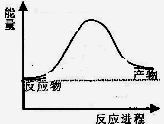
则该反应为 反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 | C—H | O—H | C=O | H—H |
| 吸收热量(kJ/mol) | a | b | c | d |
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生
CH4(g)+ 2H2O(g)
 CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。则 ① 前4s以H2O(g)浓度变化表示的平均反应速率为多少?②4s时,混合气体中H2的体积分数为多少?③ 平衡时,CH4的浓度是多少?
(要求:写出计算过程)