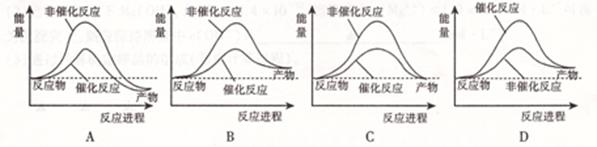
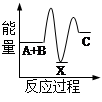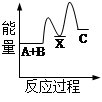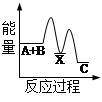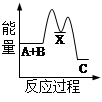题目内容
已知Zn(s)+ H2SO4(aq)= ZnSO4(aq)+ H2(g) ΔH<0;则下列叙述不正确的是
| A.该反应的ΔH值与反应物用量无关 |
| B.该反应的化学能可以转化为电能 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量 |
D
解析试题分析:A、具体的反应方程式写出来后,ΔH的值就是固定了,与反应物用量无关;B、自发氧化还原反应,可以制成原电池;C、 ΔH<0,放热反应;D、断旧键吸收能量,生新键放出能量。
考点:本题考查化学反应与能量的关系。

练习册系列答案
相关题目
在下列各说法中,正确的是( )
A.对于2SO2(g)+O2(g)  2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ 2SO3(g) ΔH=-QkJ·mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ |
| B.热化学方程式中的化学计量数不能用分数表示 |
| C.Zn(s)+H2SO4(aq) =ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能 |
| D.ΔH的大小与热化学方程式的化学计量数无关 |
已知反应 ①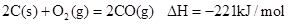
②稀溶液中,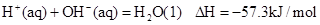 ,下列结论正确的是
,下列结论正确的是
| A.碳的燃烧热为110.5kJ/mol |
| B.2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ |
| C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是 ( )
A.碳酸钠的水解反应:CO32-+H2O  HCO3-+OH- HCO3-+OH- |
B.FeCl3水解的离子方程式:Fe3++3H2O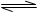 Fe (OH)3+3H+ Fe (OH)3+3H+ |
| C.稀溶液中强酸与强碱的中和热:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ· mol-1 |
| D.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g)△H = 110.5kJ·mol-1 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH3OH(g) + H2O(g) → CO2(g) + 3H2(g) – 49.0 kJ
下列说法正确的是
| A.1 LCH3OH蒸汽与1 L水蒸汽反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ |
| B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量 |
| C.相同条件下1molCH3OH(g)与1mol H2O(g)的能量总和小于1molCO2(g)与3 mol H2(g)的能量总和 |
| D.1 molCH3OH蒸汽与1 mol液态水反应生成1mol CO2气体与3 mol 氢气吸收的热量小于49.0 kJ |
能源是当今社会发展的三大支柱之一。有专家提出:如果能够利用太阳能使燃料燃烧产物,如CO2、H2O、N2等重新组合(如图),可以节约燃料,缓解能源危机。在此构想的物质循环中太阳能最终转化为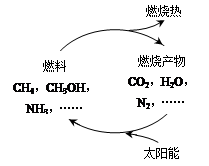
| A.化学能 | B.热能 |
| C.生物能 | D.电能 |
化学反应H2+Cl2===2HCl的能量变化如图所示,则下列说法正确的是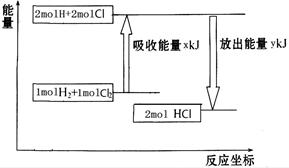
| A.该反应是放热反应 |
| B.断裂1 mol H—H键和1 mol Cl—Cl 键放出x kJ能量 |
| C.断裂1 mol H—Cl键需要吸收y kJ的能量 |
| D.2 mol HCl的总能量高于1 mol H2和1 molCl2的总能量 |