题目内容
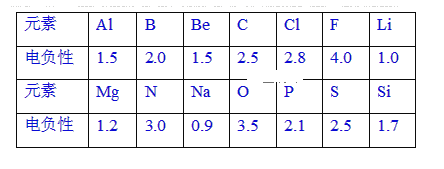
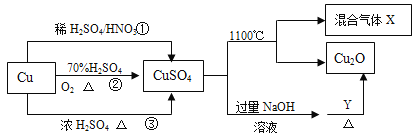
【题目】CuSO4 是一种重要化工原料,其制备和有关性质如图所示。
(1)现要用密度为 1.84g/mL,质量分数为 98%的浓硫酸来配制步骤①中所需要的 2mol/L 的稀硫酸480mL,需要用这种浓硫酸的体积为_____mL。
(2)配制该稀硫酸所用到的玻璃仪器除玻璃棒、量筒外还有_____。
(3)下列操作会使所配溶液浓度偏高的是_____。
A. 硫酸转移至容量瓶后,没有洗涤烧杯
B. 未冷却至室温就转移至容量瓶
C. 容量瓶中存在少量蒸馏水
D. 定容时俯视刻度
E. 用量筒量取浓硫酸后洗涤量筒
(4)制取硫酸铜的途径①②③中,不用_____途径,原因是_____。
【答案】54.3 烧杯 、500mL容量瓶、 胶头滴管 BDE ①③ 浪费原料,污染环境
【解析】
(1)依据c=![]() 计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(2)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析;
进行误差分析;
(4)从反应成本和对环境的影响角度进行分析。
(1)密度为1.84g/mL,质量分数为98%的浓硫酸物质的量浓度为:![]() mol/L=18.4mol/L,配制480mL0.1mol/L的稀硫酸,应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=2mol/L×500mL,解得V=54.3mL;
mol/L=18.4mol/L,配制480mL0.1mol/L的稀硫酸,应选择500mL容量瓶,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=2mol/L×500mL,解得V=54.3mL;
(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器为:量筒、烧杯、玻璃棒、500 mL容量瓶和胶头滴管,故还需要用到的玻璃仪器是烧杯、500mL容量瓶、胶头滴管;
(3)A.硫酸转移至容量瓶后,没有洗涤烧杯,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故A不符合题意;
B.未冷却至室温就转移至容量瓶,导致定容时加水体积偏小,溶液体积偏小,溶液浓度偏高,故B符合题意;
C.容量瓶中存在少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不符合题意;
D.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故D符合题意;
E.量筒是量出式仪器,不需要洗涤,用量筒量取浓硫酸后洗涤量筒,导致量取浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高,故E符合题意;答案选BDE;
(4)途径①是Cu与稀硫酸和硝酸反应生成CuSO4,同时生成NO气体污染环境;途径③是Cu与浓硫酸加热反应生成CuSO4,同时生成SO2气体污染环境;途径②Cu先与O2反应生成CuO,CuO与稀硫酸反应生成CuSO4,原料利用率高,且不污染环境;故不用①③途径,原因是浪费原料,污染环境。

【题目】除去下列物质中所含的少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是( )
选项 | 混合物 | 试剂 | 分离方法 |
A | 溴苯(溴) |
| 分液 |
B | 乙醇(水) |
| 过滤 |
C | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 乙酸乙酯(乙酸) |
| 分液 |
A.AB.BC.CD.D