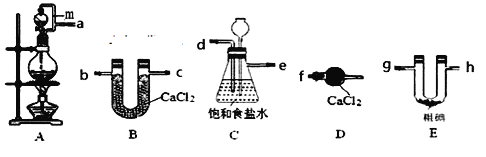
题目内容
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是![]() 、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐溶液中分别加入氨水,E和C溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀.
(1)五种盐中所含阴离子相同的两种盐的化学式是______。
(2)D溶液显碱性的原因是______(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是______,E和氨水反应的离子方程式是______。
(4)若要检验B中所含的阳离子,正确的实验方法是______。
(5)以石墨作电极,电解足量C的溶液,阳极的电极反应式为______,当转移0.2mol电子时,共产生气体______L(标准状况)。
【答案】(NH4)2SO4、Al2(SO4)3 CO32-+H2O![]() HCO3-+OH- Ag++Cl-=AgCl↓ Al3++3NH3H2O=Al(OH)3↓+3NH4+ 加NaOH加热,如能产生能使湿润的红色石蕊试纸变蓝的气体,证明有NH4+ 4OH--4e-=O2↑+2H2O 1.12
HCO3-+OH- Ag++Cl-=AgCl↓ Al3++3NH3H2O=Al(OH)3↓+3NH4+ 加NaOH加热,如能产生能使湿润的红色石蕊试纸变蓝的气体,证明有NH4+ 4OH--4e-=O2↑+2H2O 1.12
【解析】
①五种盐均溶于水,水溶液均为无色,则没有Cu2+、Fe3+;
②D的焰色反应呈黄色,则D中有Na+;
③A的溶液呈中性,B、C、E的溶液呈酸性则含有NH4+、Al3+、Ag+,D的溶液呈碱性,则D中含有CO32-,根据阳离子可知D为Na2CO3;
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀,则A、C中没有SO42-;
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失,说明C中为Ag+,则E中有Al3+;所以C为AgNO3;
⑥把A溶液呈中性分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀,则A为BaCl2;由以上分析可知E中含有Al3+,B中含有NH4+,加BaCl2均能生成不溶于稀硝酸的沉淀,则B、E中含有SO42-;所以B、E为(NH4)2SO4、Al2(SO4)3,以此解答该题。
根据上述分析可知A为BaCl2;B为(NH4)2SO4;C为AgNO3;D为Na2CO3;E为Al2(SO4)3。
(1)由以上分析可知所含阴离子相同的两种盐的化学式是(NH4)2SO4、Al2(SO4)3;
(2)D的化学式为Na2CO3;Na2CO3是强碱弱酸盐,在溶液中CO32-发生水解作用,消耗水电离产生的H+,促进了水的电离,最终达到平衡时,溶液中c(OH-)>c(H+),溶液显碱性,用离子方程式表示为:CO32-+H2O![]() HCO3-+OH-;
HCO3-+OH-;
(3)A和C的溶液反应的离子方程式为Ag++Cl-=AgCl↓,Al2(SO4)3和氨水反应的离子方程式是Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(4)检验(NH4)2SO4中所含的阳离子NH4+的方法为:取少量(NH4)2SO4于试管中,滴加少量NaOH溶液,在试管口附近放一张湿润的红色石蕊试纸,加热,若试纸变蓝,说明B中阳离子为NH4+;
(5)C中为AgNO3,电解时阳极上OH-失去电子,发生氧化反应,阳极的电极反应式为4OH--4e-=O2↑+2H2O,当转移0.2mol电子时,可生成0.05mol氧气,其在标准状况下的体积V(O2)=0.05mol×22.4L/mol=1.12L。

 学习实践园地系列答案
学习实践园地系列答案【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
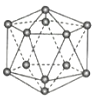
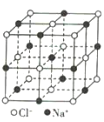
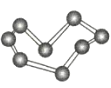
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键
【题目】在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
t/℃ | 5 | 15 | 25 | 35 | 50 |
K | 1 100 | 841 | 689 | 533 | 409 |
下列说法正确的是 ( )。
A.反应I2(aq)+I-(aq)![]() I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I3-)减小
C.该反应的平衡常数表达式为K=![]()
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689