题目内容
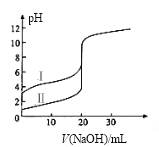
【题目】用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
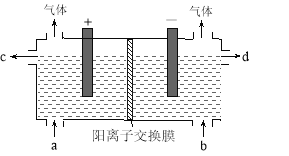
A.通电后阳极区溶液pH增大
B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O
C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成
D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出
【答案】D
【解析】
试题分析:A、左端为阳极,阳极上失去电子,发生氧化反应2Cl-2e-=Cl2↑,pH不变,故错误;B、右端是阴极区,得到电子,反应是2H++2e-=H2↑,故错误;C、根据选项A的电极反应式,通过1mol电子,得到0.5molCl2,故错误;D、根据电解原理,阳离子通过阳离子交换膜,从正极区向阴极区移动,LiOH浓溶液从d口导出,故正确。

【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程示意如下:
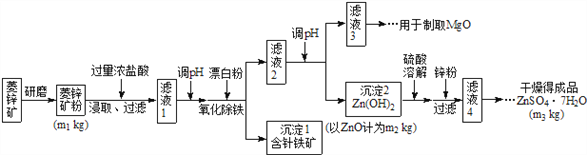
请回答下列问题:
(1)将菱锌矿研磨成粉的目的是:______________________________。
(2)漂白粉的有效成分是NaClO,请完成“氧化除铁”步骤中反应的离子方程式:_______________________
□Fe(OH)2+ □ClO- + □_____= □Fe(OH)3 + □ Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是____________(不用考虑化学式中各元素的排列顺序)。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________。
Mg(OH)2 | Zn(OH)2 | |
开始沉淀的pH | 10.4 | 6.4 |
沉淀完全的pH | 12.4 | 8.0 |
开始溶解的pH | — | 10.5 |
(5)假设各步转化均完全,分析图中数据可知:菱锌矿粉中ZnCO3的质量是_____________。