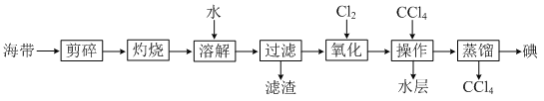
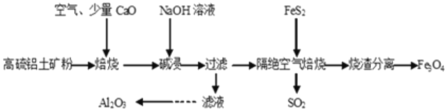
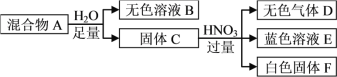题目内容
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA
B. 100g9.8%的硫酸与磷酸的混合液中含有氧原子数为0.4NA
C. 惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L
D. 0.1 mol的CaC2中含阴离子数是0.2 NA
【答案】A
【解析】A、无论钠生成Na2O还是Na2O2,1molNa都失去1mol电子,即2.3g金属钠失去电子物质的量为2.3×1/23mol=0.1mol,故A正确;B、硫酸和磷酸的水溶液中含水,且水也含有氧原子,故B错误;C、没有指明状态是否是标准状况,因此无法计算气体体积,故C错误;D、碳化钙的电子式为 ,因此0.1mol碳化钙含有阴离子的物质的量为0.1mol,故D错误。
,因此0.1mol碳化钙含有阴离子的物质的量为0.1mol,故D错误。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
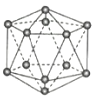
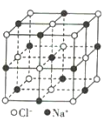
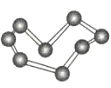
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键