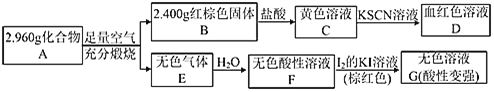
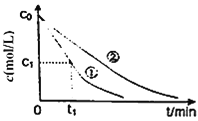
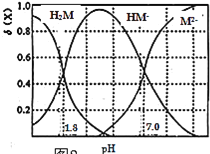
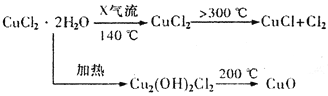题目内容
【题目】将2mol NaHCO3 和1mol Na2O2 混合,在密闭容器中充分混合加热后,最后排出气体,残留的固体是( )
A.Na2CO3B.Na2O2 和 Na2CO3
C.NaOH 和 Na2CO3D.Na2O2 和 Na2O
【答案】A
【解析】
加热时碳酸氢钠分解生成二氧化碳和水,二氧化碳和水与过氧化钠反应,反应方程式分别为:2NaHCO3![]() Na2CO3+H2O+CO2↑ 、2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+ O2↑,2mol NaHCO3分解产生1mol二氧化碳和1mol水,根据反应关系可得,生成二氧化碳、水均过量,则反应后生成的固体中不可能存在过氧化钠,过氧化钠先与二氧化碳反应,则最终产物为碳酸钠,答案选A。
Na2CO3+H2O+CO2↑ 、2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+ O2↑,2mol NaHCO3分解产生1mol二氧化碳和1mol水,根据反应关系可得,生成二氧化碳、水均过量,则反应后生成的固体中不可能存在过氧化钠,过氧化钠先与二氧化碳反应,则最终产物为碳酸钠,答案选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
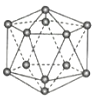
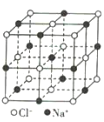
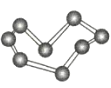
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
晶体硼(其每个结构单元中有12个B原子) | NaCl | S8 | HCN | |
结构模型示意图 |
|
|
|
|
备注 | 熔点2573K | —— | 易溶于CS2 | —— |
A.晶体硼属于原子晶体,结构单元中含有30个B-B键,含20个正三角形
B.NaCl晶体中每个Na+周围距离最近且相等的Na+有6个
C.S8分子中的共价键为非极性键
D.HCN分子中含有2个σ键,2个π键