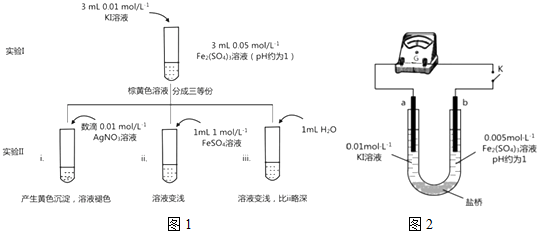
题目内容
11.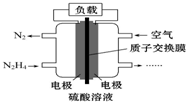 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 负极发生的电极反应式为N2H4-4e-═N2↑+4H+ | |
| C. | 利用该燃料电池工业上可以电解MgCl2溶液制备Mg | |
| D. | 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故c(H+)逐渐减小 |
分析 该燃料电池中,负极上燃料失电子发生氧化反应,左侧为负极,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,正极上氧气得电子发生还原反应,右侧为正极,电极反应式为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2↑+2H2O,结合离子的移动方向、电流的方向分析解答.
解答 解:A、燃料电池中可燃物作负极,氧气作正极,故电流从右侧电极经过负载后流向左侧电极,故A错误;
B、可燃物N2H4作负极发生氧化反应,故B正确;
C、电解MgCl2溶液阴极是H+得电子而不是Mg2+得电子,故无法制得镁,应电解熔融的MgCl2制备镁,故C错误;
D、右侧电极作正极,发生反应O2+4e-+4H+═2H2O,当消耗1 mol氧气时消耗4 mol H+,因电路中通过4 mol电子,故由左侧电极区转移过来4 mol H+,故c(H+)不变,故D错误.
故选B.
点评 本题考查了燃料电池,明确正负极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液的酸碱性书写,注意电流的方向和电子的流向相反,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等. 水垢会形成安全隐患,需及时清洗除去.清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉.
(1)用NaOH溶解二氧化硅的化学方程式是SiO2+2NaOH═Na2SiO3+H2O.
(2)已知:20℃时溶解度/g
则步骤Ⅰ中加入Na2CO3可除去水垢中的CaSO4.
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有CaCO3、Mg(OH)2、SiO2.
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因2Fe3++Fe═3Fe2+.
(4)步骤Ⅲ中,加入Na2SO3的目的是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉.(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
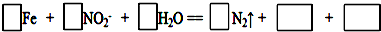
②如果有16.8g铁被钝化,则转移的电子数为4.82×1023(保留三位有效数字).
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉.
(1)用NaOH溶解二氧化硅的化学方程式是SiO2+2NaOH═Na2SiO3+H2O.
(2)已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有CaCO3、Mg(OH)2、SiO2.
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因2Fe3++Fe═3Fe2+.
(4)步骤Ⅲ中,加入Na2SO3的目的是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉.(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
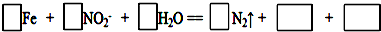
②如果有16.8g铁被钝化,则转移的电子数为4.82×1023(保留三位有效数字).
3.牙齿洁白,人人喜欢.将漂白剂沾在牙套上,牙齿咬住牙套可使牙齿变得洁白.下列物质溶于水后所得溶液可作为牙齿漂白剂的是( )
| A. | Cl2 | B. | HNO3 | C. | Na2O2 | D. | H2O2 |
20.下列除去杂质(括号内的是杂质)所选用的试剂合理的是( )
| A. | Al (Fe):浓硝酸 | B. | MgO(Al2O3):盐酸 | ||
| C. | FeCl3(FeCl2):氯水 | D. | FeCl2(CuCl2):氢氧化氢钠溶液 |
1.下列各组物质,其分子数相同的是( )
| A. | 1gH2和8g O2 | |
| B. | 1molCO和22.4L水蒸气(一个标准大气压、100℃) | |
| C. | 18g水和标况时22.4L CO2 | |
| D. | 3molSO2和2mol SO3 |
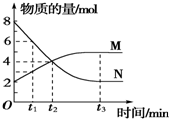 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题:
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题: